中国胸外科围手术期疼痛管理专家共识(2018 版)
作者:胸心分会办公室来源:胸心分会办公室
点击:3757次时间:2019-01-10 16:14:40
点击:3757次时间:2019-01-10 16:14:40
中国医师协会胸外科医师分会微创外科专家委员会
通信作者:刘伦旭,Email:lunxu_liu@aliyun.com;赫捷,Email: prof.hejie@263.net
关键词:微创手术; 镇痛; 胸外科; 围手术期; 专家共识
引用本文:中华医学会胸心血管外科学分会胸腔镜外科学组中国医师协会胸外科医师分会微创外科专家委员会. 中国胸外科围手术期疼痛管理专家共识(2018 版). 中国胸心血管外科临床杂志, 2018, 25(11): 921-928. doi: 10.7507/1007-4848.201810052
正 文
围手术期镇痛,尤其是术后镇痛越来越受到医患的关注与重视。安全有效的术后疼痛管理是加速康复外科的主要组成部分。术后疼痛管理的有效性,不仅可以最大限度地降低患者的疼痛,而且有助于患者早期活动及功能恢复,达到缩短住院时间,减少医疗费用和提升住院满意度的效果,更重要的是可有效避免术后慢性疼痛等相关并发症的发生。
胸外科手术针对的疾病主要包括肺癌、食管癌、纵隔肿瘤、胸壁畸形等,这些手术因范围广、创伤大,是术后疼痛最严重的外科手术。有研究报道,即使采用电视辅助胸腔镜手术(video-assistedthoracoscopic surgery,VATS),仍有 78% 的术后患者存在中至重度疼痛:其中 27% 为中度疼痛,34% 为重度疼痛,17% 为极重度疼痛[1]。58% 的开胸手术患者出院后 1 个月仍有中至重度疼痛[2]。同时,患者术后 C-反应蛋白(C- reactive protein,CRP)、白介素-6(interleukin-6,IL-6)、白介素-10(interleukin-10,IL-10)等炎症因子水平升高[3]。由此可见,胸外科患者术后疼痛较严重、很常见且情况复杂,包含了炎症性疼痛、躯体痛、内脏痛、神经病理性疼痛等急性和慢性疼痛。然而,文献[4]报道显示仅有不足 50% 的术后患者能得到充分镇痛。术后疼痛不仅给患者带来极大痛苦,还可导致呼吸循环功能、内分泌功能、免疫功能等改变以及肺不张、肺炎、低氧血症、高碳酸血症等并发症,甚至造成慢性疼痛,严重影响患者的治疗效果、功能恢复和生活质量[5]。因此有效、规范化的疼痛管理至关重要。
为更好地推动我国胸外科术后疼痛管理的规范化,特结合国内胸外科专家的建议及临床证据制定了本共识,以期为胸外科医生提供更为规范的术后疼痛诊疗实践指导。本共识为学术性建议,仅限于指导胸外科围手术期疼痛管理,不适用于胸外科所涉及的肿瘤及其它疾病导致的癌性或慢性疼痛。
1.疼痛分类
(1)根据疼痛的持续时间,可以分为急性疼痛和慢性疼痛。急性疼痛是指在短期内(3 个月以内)存在的疼痛;慢性疼痛是指一种急性疾病或一次损伤所引起的疼痛持续超过正常所需的治愈时间,或疼痛缓解后间隔数月或数年复发或反复发作者为慢性疼痛,多为持续存在 3 个月以上的疼痛[6]。
(2)根据疼痛的严重程度,可以分为轻度疼痛、中度疼痛和重度疼痛。
(3)根据疼痛的神经生理学机制可分为伤害感受性疼痛、神经病理性疼痛及混合性疼痛三类,伤害感受性疼痛直接由伤害性刺激引起,与组织损伤或炎症反应有关,而后者由神经系统原发性损害和功能障碍所激发或引起疼痛。
(4)根据疼痛的部位可以分为:手术后躯体痛(伤口痛),为手术中所用器械直接损伤和波及的部位所引起的疼痛;手术后内脏痛(牵涉痛),为胸腔手术损伤内脏组织所引起的疼痛[7]。
表1 术后疼痛程度常用评估方法
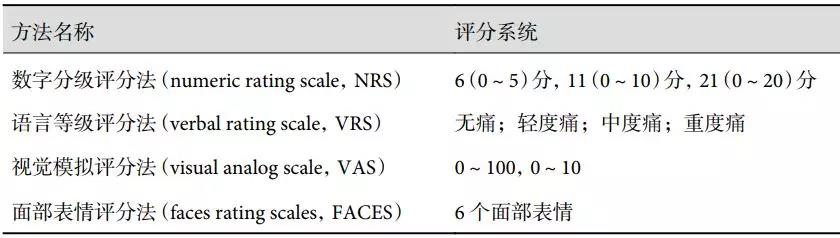
临床常用的疼痛评估方法主要包括数字分级评分法(numeric rating scale,NRS),语言等级评分法(verbal rating scale,VRS),视觉模拟评分法(visual analog scale,VAS)和面部表情评分法(faces rating scales,FACES)等,见表 1[8-9]。
NRS 最常用的为 0~10 分评分,患者用这 11。个数字表达疼痛程度。通常可用疼痛对日常生活及睡眠的影响提示疼痛程度。若疼痛完全不影响日常生活,疼痛评分<4 分,为轻度痛;若疼痛影响日常生活,仍可自然入睡,无睡眠中痛醒,疼痛评分为 4~6 分,为中度痛;若疼痛导致不能睡眠,需用镇痛药物或其他辅助手段帮助睡眠,疼痛评分为7~10 分,为重度痛。该方法直观,易于患者理解和表达,明显减轻医务人员负担。其缺点是患者容易受到数字和描述字的干扰,使其灵敏性和准确性降低,难以捕获特异性和复杂性的疼痛感受[10]。
VRS 通过患者口述描绘评分,让患者根据自身的疼痛程度选择相应关键词:无痛、轻度痛、中度痛、重度痛。该方法简易,易于医师与患者沟通。但容易受情绪、理解程度和文化水平的影响[11]。
VAS 是临床上常用而简单有效的疼痛评估方法,通常包括 2 种方法:(1)专用量表法:① 在纸上或尺上划出 10 cm 长的直线,按毫米划格,一端为无痛,另一端为极痛。划线方法可为横线,也可为竖线。② 患者目测后根据自身情况用笔在直线上划出与其疼痛程度相符合的某点。③ 以 0~100范围内的数字表示疼痛程度。④ 重复 2 次,取 2 次的平均值。(2)游动标尺法:标尺正面为可游动的标尺,背面为 0~10 cm 的 VAS 游动标尺(可精确到毫米)。患者移动标尺正面到自己感觉的疼痛位置时,医生立即从背面读出数值。该方法广泛适用于患者术后疼痛评估。其缺点是不能通过电话随访进行,限制了其实用性[12]。
FACES 通过 6 个不同的呈水平排列的面部表情,让患者选择最能代表疼痛程度的表情,以此进行疼痛评估。该方法最初用于儿童疼痛程度评估,具有易掌握、耗时短、不需要其他辅助设备的优点,但等级过少不够准确[13]。
另外,术后疼痛评估除了疼痛程度,还应包括疼痛的出现时间、部位(切口处、牵涉部位或其他部位)、频率、疼痛程度是否有变化、诱因、加重或缓解因素、是否影响睡眠、是否影响日常活动、既往疼痛治疗情况、疼痛评估是否有障碍(语言、文化障碍)等[14-15]。
3.胸外科围手术期常见疼痛原因
胸外科围手术期疼痛常见原因包括:手术创伤、留置引流管、肋间神经损伤或压迫、胸膜受损、焦虑或紧张等情绪、术后体位不适等[16]。胸外科手术造成的包括手术切口刺激和炎症因子刺激在内的伤害性刺激,可激活外周和中枢神经的痛觉敏化,进而造成患者术后急性疼痛。急性疼痛若没有控制好,可引起外周神经末梢致敏、中枢神经致敏和神经调节功能下降,部分患者可能发展为慢性疼痛[5]。
4.术后疼痛管理
术后镇痛对于促进患者术后尽早恢复、降低术后并发症发生率是十分重要的。
4.1疼痛管理目标[17]
(1)安全、持续、有效镇痛;(2)无或仅有可忍受的轻度不良反应;(3)最佳的躯体和心理、生理功能,最高的患者满意度;(4)利于患者术后康复,改善患者生活质量。
4.2术后镇痛原则
推荐患者采用预防性或按时、按需镇痛[18-19],以达到最佳的镇痛效果和最小的不良反应。多模式镇痛方案的重要原则是非甾体类抗炎药( nonsteroidal anti-inflammatory drugs,NSAIDs)为术后镇痛基础用药,尽量减少阿片类药物的使用,以减少阿片类药物引起的不良反应如肠麻痹等。
按时镇痛:根据药物代谢时间按时给药,维持平稳有效的镇痛血药浓度,减轻患者的疼痛[20]。在规定时间段内,评估患者疼痛程度并给予有效的镇痛方案。
按需镇痛:根据个体差异,依照患者需求,给予个性化的镇痛方案。现在多建议将按时镇痛与按需镇痛相结合,即持续给予小剂量镇痛,按患者需要追加镇痛药物。
预防性镇痛:手术创伤和术后炎症反应会导致患者中枢及外周痛觉敏化[21],预防性镇痛即从术前到术后一段时期,采用持续的、多模式的镇痛方案进行预防性镇痛,实现长时间覆盖术前、术中和术后的有效镇痛,从而减少手术应激和痛觉敏化。推荐选择可以通过血脑屏障的药物用于预防性镇痛。
4.3术后镇痛方案
4.3.1主要镇痛方式
胸外科手术术后常用的镇痛方式主要包括:(1)全身镇痛,如口服镇痛药、静脉注射镇痛[ 包括患者静脉自控镇痛( p a t i e n t controlled intravenous analgesia,PCIA)]、肌肉注射镇痛等;(2)局部镇痛,如局部浸润麻醉镇痛、外周神经阻滞(包括肋间神经阻滞)、硬膜外镇痛等。各种镇痛模式均有其优缺点。静脉镇痛效果优于肌肉注射镇痛,但静脉镇痛恶心呕吐、皮肤瘙痒、呼吸抑制发生率高,肌肉注射镇痛的患者术后烦躁发生率高[22]。口服镇痛药和静脉自控镇痛的操作简单易行、安全、副作用小,不影响患者活动为其独特优势,但因患者的个体差异大及全身影响,难以达到稳定而适当的血药浓度[23-24]。局部浸润镇痛不经全身给药,不仅能够提供良好的镇痛效果,还能减少全身用药带来的不良反应,减少儿茶酚胺类的释放,从而为伤口愈合提供更好的血液灌注和氧供,但存在反复进行额外有创操作的问题[25]。外周神经阻滞可有效阻滞疼痛的传入途径,减少中枢敏感化的形成,可减少患者对阿片类药物的需求及其相关副作用,对机体病理生理影响小,但在临床上广泛推广存在问题[26]。硬膜外镇痛将局部麻醉药注入硬膜外腔,抑制交感神经系统兴奋,有效调节细胞因子平衡,抑制炎性反应,进一步降低总体阿片类药物用量,但其可引起硬膜外血肿、全脊髓麻醉和硬膜外腔感染等并发症,限制了其在临床上的应用[27]。故临床上常采用多模式镇痛方案。
4.3.2多模式镇痛
多模式镇痛一方面是指镇痛方法的联合,包括 PCIA 、口服用药、静脉注射、肌肉注射等全身性使用镇痛药物的方法与局部浸润麻醉、外周神经阻滞、胸椎旁神经阻滞、硬膜外阻滞麻醉等局部镇痛方法的联合使用。多模式镇痛可减少术后阿片类镇痛药物的用量,增强镇痛效果,缩短住院日。PCIA 具有起效较快、无镇痛盲区、血药浓度相对稳定、可通过冲击(弹丸)剂量及时控制爆发痛,并有用药个体化、患者满意度高等优点,是目前术后镇痛最常用的方法,适用于术后中至重度疼痛[28]。该模式虽无严重并发症及明显创伤,但其镇痛药物存在恶心、呕吐、血流动力学不稳定和潜在依赖性的风险。在镇痛模式中,外周神经阻滞、胸椎旁神经阻滞和硬膜外镇痛为目前有效的镇痛方法,但均需麻醉医生行有创操作。
多模式镇痛另一方面是指镇痛药物的联合,包括阿片类药物、NSAIDs、对乙酰氨基酚及抗神经病理性疼痛药物等的联合使用。但如何联合能够达到最佳镇痛效果和最少不良反应,目前还无定论。。
4.3.3其他镇痛方案
其他非药物镇痛方案包括:物理治疗(冷疗、热疗、休闲治疗、超声治疗、矫正治疗)、综合治疗(按摩、针灸、音乐疗法)、心理学治疗(认知行为治疗、想象疗法)、神经刺激疗法(经皮神经电刺激、外周神经刺激)[29]。以上干预措施的实施必须考虑已有诊断和合并疾病,并且需要仔细评估不良反应。
5.常用镇痛药物
镇痛药物包括 NSAIDs、阿片类镇痛药、对乙酰氨基酚等。
5.1非甾体类抗炎镇痛药(NSAIDs)
NSAIDs 是外科患者术后多模式镇痛的基础药物,分为非选择性 NSAIDs 和选择性 NSAIDs,此类药物具有解热、镇痛、抗炎、抗风湿作用,主要作用机制是抑制环氧合酶(cycloxygenase,COX)和前列腺素(prostaglandin,PG)的合成。前者代表药物包括氟比洛芬酯等,后者包括帕瑞昔布、塞来昔布等。研究发现氟比洛芬酯可以透过血脑屏障[30],发挥中枢镇痛作用,可用于预防性镇痛。同时其也是唯一可以入泵用药的 NSAIDs[31]。其他 NSAIDs 预防性镇痛的疗效尚需要更多研究来证实。 非选择性 NSAIDs 的主要副作用是胃肠道不良反应,甚至导致胃溃疡的发生,但其在节省阿片类药物用量、降低阿片类药物相关不良反应方面更具优势,更适合多模式镇痛[32]。而选择性 NSAIDs 的优势在于不会抑制具有胃肠道保护作用的 COX-1,降低了胃肠道不良反应的发生,但存在增加患者心血管不良事件的风险[33]。因此临床应用 NSAIDs 时需权衡治疗获益和风险。
5.2阿片类药物
阿片类药物通过结合中枢神经系统和外周的阿片受体发挥止痛镇静作用。目前已明确的阿片类受体包括 μ、κ、δ、σ 和 ε 5 型,其中 μ、κ 和 δ 受体都与镇痛效果的发挥有关。根据镇痛强度可分为弱阿片类和强阿片类药物。弱阿片类主要用于轻、中度急性疼痛的口服镇痛,主要包括可待因、双氢可待因、曲马多等。而强阿片类主要用于重度疼痛的镇痛,主要包括芬太尼、舒芬太尼、吗啡、哌替啶、羟考酮等。阿片类药物的不良反应为剂量依赖性,包括:恶心、呕吐、便秘、瘙痒、镇静、呼吸抑制等[34]。阿片类药物作用机制可以看出其无抗炎的作用,还可导致痛觉敏化[35]。因此现在多认为应当尽可能地减少阿片类药物的使用。地佐辛作为阿片受体激动-拮抗剂,其镇痛作用与吗啡相似,呼吸抑制轻,有研究表明不论是镇痛作用还是其副作用都具有封顶效应[36-37],故联合使用其他类别镇痛药有一定的协同作用。盐酸羟考酮是目前唯一的纯阿片 μ 和 κ 双受体激动阿片类镇痛药,对于内脏痛、癌性痛和术后疼痛治疗有显著的效果,且起效快、不良反应少,呼吸抑制作用轻微[38]。
5.3对乙酰氨基酚
可抑制中枢神经系统合成 PG,从而发挥解热镇痛的作用。相比 NSAIDs 副作用更少,对胃黏膜无明显刺激。单独应用对轻至中度疼痛有效,与阿片类或曲马多或 NSAIDs 药物联合应用,可发挥镇痛相加或协同效应。但临床应用应当注意其肝脏损伤的风险,FDA 2014 年 1 月 14 日发布通告建议停止给患者每剂高于 325 mg 的对乙酰氨基酚合剂处方,没有证据表明使用每剂超过 325 mg 对乙酰氨基酚能够提供大于其肝脏损害风险的益处,因而限制剂量可减少因疏忽而造成的对乙酰氨基酚过量引发的肝脏衰竭甚至死亡的风险[39]。
5.4局部镇痛药物
目前广泛用于胸外科术后镇痛的局部镇痛药物主要有:(1)利多卡因:是常用的酰胺类局部麻醉剂,其穿透细胞能力强,起效迅速,一般 3 min 以内起效,作用时间可持续约 3 h。(2)罗哌卡因:为酰胺类局部麻醉药,意外将其注入血管,可能立即产生急性全身性毒性。除了局部浸润麻醉,还可用硬膜外麻醉。(3)布比卡因:为酰胺类局部麻醉药,需要静脉注射给药,作用时间长,半衰期为 2.7 h,药物过量可能导致心血管和中枢神经系统毒性作用。(4)氯普鲁卡因:局部浸润常用 1% 或 2% 的溶液,临床上用于局部浸润麻醉、神经阻滞麻醉、骶管和硬膜外麻醉。当药物误入蛛网膜下腔时,患者即可发生惊厥、通气不足和窒息。
5.5其他镇痛药物
氯胺酮是 N-甲基-D-天冬氨酸(N-methyl-Daspartic acid,NMDA)受体拮抗药,静脉注射过量或速度过快时可产生呼吸抑制。加巴喷丁和普瑞巴林是 α2、δ 受体阻滞药,两者最初多用于成人疱疹后神经痛的治疗。术前静脉注射小剂量氯胺酮(0.2~0.5 mg/kg)或口服普瑞巴林(150 mg)、加巴喷丁(900~1 200 mg)对术后镇痛和抑制中枢敏化有重要作用,同时还可减少阿片类药物使用。肾上腺糖皮质激素(glucocorticoids,GCs)作为临床上常用的一类药物,近年来也被用于术后辅助镇痛治疗。有研究和共识指出,GCs 虽然不能直接抑制手术创伤导致的急性疼痛,但其消除炎症和减轻水肿的作用可缓解患者术后水肿压迫神经导致的疼痛,且与局部麻醉药物联用时,可增强镇痛效果,延长镇痛时间[40-41]。右美托咪定是高选择性 α2 肾上腺素能受体激动药,通过作用于中枢神经系统和外周神经系统的 α2 受体产生镇痛、镇静、抗焦虑、降低应激反应、稳定血流动力学等广泛功效,该药联合阿片类药物及其他镇痛药物用于术后静脉自控镇痛能显著降低阿片类药物和其他镇痛药用量,同时改善疼痛评分[42]。镇痛药的多样化,使联合用药更普遍,也是目前术后镇痛的常规措施,但联合用药的药物选择、组合仍是目前临床医生的一大难题及研究热点。
6.胸外科疼痛管理策略
6.1多学科综合诊治
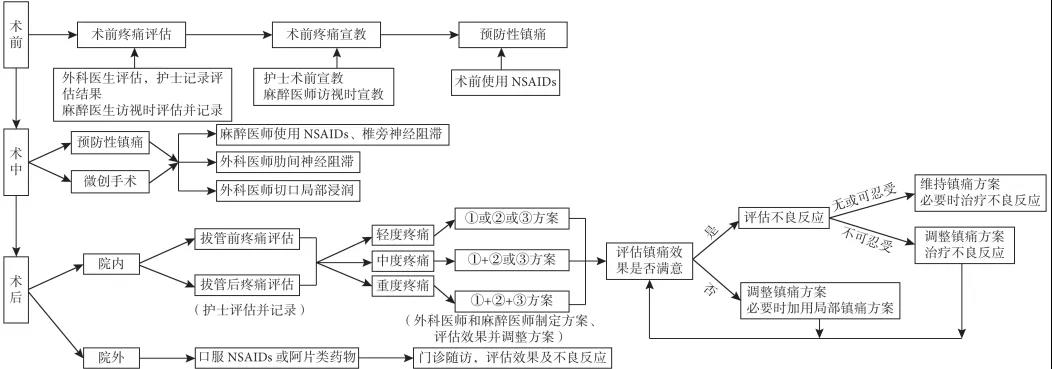
推荐:联合胸外科、麻醉科和护理团队多学科综合诊治,推荐胸外科围手术期疼痛管理流程见图 1。
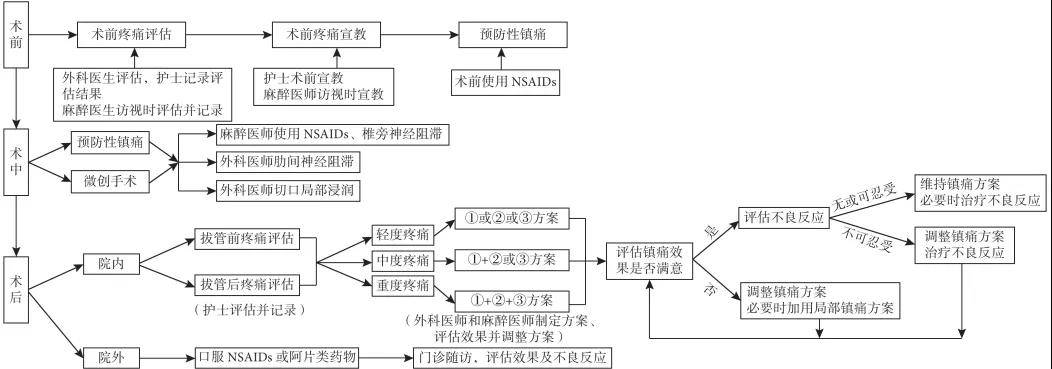
图1 胸外科围手术期疼痛管理流程
方案 ①:PCIA 阿片类药物或 NSAIDs;方案 ②:口服 NSAIDs 或阿片类药物;方案 ③:静脉注射/滴注或肌肉注射阿片类药物或 NSAIDs
胸外科患者的围手术期疼痛管理是一项复杂的工作,涵盖了患者术前、术中和术后多个阶段。因此与患者这几个阶段直接相关的学科和团队,如麻醉科和护理团队,都应该加入到胸外科患者围手术期疼痛管理中。三方都在患者疼痛管理全程中的不同阶段担任评估者、制定者、记录者和执行者。主管患者的胸外科医师需要评估患者的疼痛状态,制定和执行部分术前和术中预防性镇痛方案,制定和调整术后镇痛方案并指导患者院外镇痛。麻醉医师也需要同胸外科医师一起在术前评估患者的疼痛状态,参与术前疼痛宣教,制定、执行并调整部分术中和术后镇痛方案。护理团队需配合外科医师和麻醉医师记录疼痛评估的结果,参与术前疼痛宣教、术后疼痛评分,执行具体镇痛措施。6.2术前疼痛评估
推荐:术前进行充分的疼痛评估,包括生理和心理疾病、慢性疼痛病史、既往疼痛治疗及效果、用药史、过敏史、认知状态、治疗期望等。
患者入院后,外科医师应对其进行早期全面的疼痛评估,从疼痛的各个方面进行深入的了解,获取患者既往疼痛相关治疗情况,明确患者术后疼痛相关危险因素,从而指导镇痛药物的选择。通过对认知状态的评估,可指导术后疼痛评估工具的选择。了解患者治疗期望,是对患者进行人文关怀的重要内容,以此对患者进行更加个性化的镇痛方案,也有利于激励患者加入到镇痛全程管理中。护士需配合外科医师的评估工作,将评估结果记录在护理记录中。另外,麻醉医师在术前访视患者时也应对其进行术前疼痛方面的评估。
6.3术前疼痛宣教
推荐:充分的术前疼痛宣教有助于患者术后疼痛的控制,减少阿片类药物的使用,加速患者康复。
焦虑、抑郁等情绪是影响患者疼痛的独立危险因素,疼痛也会加重患者焦虑、抑郁等情绪。研究发现胸外科手术患者术前采用有效沟通可以减少患者术后疼痛强度、减少术后 48 h 内阿片类药物的使用量[43]、减少术前焦虑[44]、加速患者康复[45]。因此围手术期要注重对患者及其家属进行疼痛宣教[46],鼓励患者主动报告自己的疼痛体验,消除患者害怕镇痛药物成瘾、药物严重不良反应的顾虑和担心,使得患者及其家属高效地参与到疼痛全程管理中。术前疼痛宣教可由护士在手术前一天进行,其内容包括但不限于疼痛出现原因、术后疼痛评估方法、术后镇痛方案、术后镇痛药物、可能的不良反应以及术后疼痛管理的目标等信息。麻醉医师也应当在访视时对患者进行宣教。
术前疼痛宣教的形式包括一对一的沟通法、宣传资料的发放、播放宣教视频、新媒体平台推送等多形式多渠道的疼痛宣教。宣教内容应当考虑患者年龄、语言、受教育程度、宗教信仰等因素,为患者提供个体化的宣教内容[47]。
6.4预防性镇痛
推荐:术前采用氟比洛芬酯、帕瑞昔布(磺胺类过敏禁用)用于全身预防性镇痛。术中采用局部镇痛药物阻滞胸椎旁神经、肋间神经或切口周围浸润用于局部预防性镇痛。
目前预防性镇痛的应用尚存争议,但研究发现术前预防性使用氟比洛芬酯,可有效降低患者术后疼痛评分、术后阿片类药物消耗量及减少炎症反应,同时有助于患者术后恢复呼吸功能[48]。因此建议术前 1 d 使用 NSAIDs 进行预防性镇痛,选择可以透过血脑屏障的药物如氟比洛芬酯,能发挥抑制中枢及外周痛觉敏化的作用,达到更好的镇痛疗效。同时建议麻醉医师在术中或麻醉复苏前使用NSAIDs 进行全身预防性镇痛。荟萃分析研究显示硬膜外预防镇痛能够使开胸患者获益,而局部浸润麻醉能够使腹部外科患者获益[49-50]。因此建议胸外科医师术中采用局部镇痛药物阻滞肋间神经或切口周围浸润用于局部预防性镇痛。
6.5减少手术创伤
推荐:采用微创的方式进行手术,减少手术创伤。
胸腔镜微创手术无需撑开肋骨,且切断的胸壁肌肉少,创伤较传统开胸手术小。研究证实胸腔镜微创手术与开胸手术相比,能显著减轻患者术后疼痛,尤其是围手术期的疼痛,有利于患者康复[51-53]。即使采用胸腔镜微创手术,我们仍然需要注意在术中尽量轻柔操作,合理规划手术范围,避免造成不必要的创伤。切开胸壁时,尽量避开肋间神经,当手术操作时,尽量保护切口,避免器械对切口及神经的挤压。针对部分早期肺癌手术,可以仅行肺叶特异性淋巴结清扫或部分纵隔淋巴结采样,以减少手术造成的创伤。
6.6术后疼痛管理
推荐:科学合理及时的疼痛评估及制定相应的镇痛方案在疼痛全程管理中至关重要。
根据患者实际情况(如年龄、表达能力、理解能力等)选择合适的疼痛评估量表进行评估,患者疼痛评估要包含静息时和活动时(如咳嗽等)的疼痛程度。护士对患者疼痛评估应在术后当天睡前评估 1 次;拔管前,每日评估 2 次;拔管后,每日评估 1 次。护士获得并记录患者疼痛评估结果后再由外科医师制定相应的镇痛方案。术后疼痛评估记录表见表 2。镇痛方案中,虽然超声引导下椎旁神经阻滞技术、竖脊肌筋膜下阻滞技术及硬膜外镇痛等局部镇痛方案效果最为显著,可以显著降低阿片类药物的用量,从而减轻其副作用,缩短住院日,达到术后快速康复,是多模式镇痛方案的重要组成部分。但因为需要麻醉科或疼痛科的协助,操作难度较大,并发症也较多。推荐患者术后采用PCIA+静脉注射或口服镇痛的多模式镇痛方案,以NSAIDs 和阿片类镇痛药物为基础,必要时辅以局部镇痛方案。PCIA 方案中的药物选择由麻醉医师制定。使用多模式镇痛方案时应注意避免同一药物重复使用。
表2 术后疼痛记录表

该表格仅作为示例,具体使用时可进行扩展以满足填写需求。疼痛部位包括手术切口、引流管口、腹壁及其他,疼痛性质包括刺痛、胀痛、麻木及其他
6.6.1 NRS 的应用范例(1) 若 1≤NRS<4 分,为轻度疼痛,则采用以下三种治疗方案中的任意一种:① PCIA 阿片类药物或 NSAIDs;② 口服 NSAIDs或阿片类药物;③ 静脉注射/滴注或肌肉注射阿片类药物或 NSAIDs。用药时建议首选 NSAIDs。
(2) 若 4≤NRS≤6 分,为中度疼痛,(1)中 ①方案联合 ② 或 ③ 方案中的一种同时使用。口服用药后 1 h 再次评估;静脉用药后 15~30 min 内复评,并进行用药记录及疼痛复评记录。
(3) 若 NRS≥7 分,为重度疼痛,联合(1)中三种治疗方案同时使用,并持续追踪、记录患者疼痛及用药情况。患者出院后由专人随访评估患者疼痛情况。
6.6.2对镇痛效果的评估和不良反应的处理
外科医师和麻醉医师应在镇痛方案实施后对其效果及不良反应进行评估和记录,并根据情况调整治疗方案以及处理不良反应。单用或联用上述镇痛方案效果不佳时,可采取切口局部浸润或请麻醉科或疼痛科会诊后进行外周神经阻滞等局部镇痛方案。(1)若患者镇痛效果满意,但不良反应无法耐受,则需调整剂量、更换镇痛药物或调整剂量后联合用药并治疗不良反应。(2)若患者镇痛效果满意,不良反应可以耐受,则维持目前镇痛方案,并密切观察患者情况变化,必要时治疗不良反应。(3)若患者镇痛效果不佳,不论是否出现不良反应,则均需要更换镇痛药物或调整剂量后联合用药。必要时治疗不良反应。
7.院外疼痛管理
推荐:患者出院后可口服 NSAIDs 或阿片类药物镇痛,但需注意长期用药的不良反应。鼓励患者定期到门诊随访复查,进行面对面疼痛评估,根据随访结果制定或修改镇痛方案。如口服药物镇痛效果不佳,可采用外周神经阻滞等局部镇痛方案。
有研究[53- 54]表明,胸科手术术后慢性疼痛发生率高,且患者生活质量评分降低,不利于患者的康复。因此,临床医生还应注意术后急性疼痛的有效控制,预防术后急性疼痛向慢性疼痛转化。对于有慢性疼痛、保守治疗无效或出现了疼痛相关功能障碍的患者,除谨慎开具镇痛药物外,并告知患者及家属长期用药的获益和风险,必要时联合非药物治疗(如冷疗、针灸、按摩、认知行为疗法、经皮神经电刺激等)外,应尽早邀请疼痛专科医师介入,尽早干预治疗。慢性疼痛治疗目标为改善功能、减少长期疼痛的不良影响以及疼痛治疗带来的不良反应。需要多学科、多模式镇痛方案,包括药物和非药物治疗。
中国胸外科围手术期疼痛管理专家共识(2018 版)专家组
指导专家:赫捷(中国医学科学院北京协和医学院肿瘤医院)、王天佑(首都医科大学附属北京友谊医院)、张逊(天津市胸科医院)
执笔者:朱云柯(四川大学华西医院胸外科)、林琳(四川大学华西医院胸外科)、廖虎(四川大学华西医院胸外科)、周健(四川大学华西医院胸外科)、刘慧(四川大学华西医院疼痛科)、余海(四川大学华西医院麻醉科)、刘伦旭(四川大学华西医院胸外科)
专家组成员(以姓氏拼音排名):车国卫(四川大学华西医院)、陈椿(福建医科大学附属协和医院)、陈刚(广东省人民医院)、陈海泉(复旦大学附属肿瘤医院)、陈克能(北京大学肿瘤医院)、陈亮(江苏省人民医院)、陈周苗(浙江大学医学院附属邵逸夫医院)、初向阳(解放军总医院)、崔键(哈尔滨医科大学附属第四医院)、达嘎(青海大学附属医院)、傅剑华(中山大学肿瘤防治中心)、付军科(西安交通大学第一附属医院)、付向宁(华中科技大学同济医学院附属同济医院)、高树庚(中国医学科学院北京协和医学院肿瘤医院)、高禹舜(中国医学科学院北京协和医学院肿瘤医院)、龚珉(首都医科大学附属北京友谊医院)、顾春东(大连医科大学附属第一医院)、郭占林(内蒙古医学院附属医院)、何建行(广州医科大学附属第一医院)、胡坚(浙江大学医学院附属第一医院)、黄云超(云南省肿瘤医院)、姜格宁(同济大学附属上海市肺科医院)、矫文捷(青岛大学附属医院)、李高峰(云南省肿瘤医院)、李辉(首都医科大学附属北京朝阳医院)、李简(北京大学第一医院)、李强(四川省肿瘤医院)、李单青(中国医学科学院北京协和医学院北京协和医院)、李文涛(上海交通大学附属胸科医院)、李小飞(空军军医大学唐都医院)、李印(中国医学科学院北京协和医学院肿瘤医院)、林昌锦(首都医科大学附属北京友谊医院)、林风武(吉林大学中日联谊医院)、刘德若(北京中日友好医院)、刘军(北京大学人民医院)、刘俊峰(河北医科大学第四医院)、刘伦旭(四川大学华西医院)、刘志东(首都医科大学附属北京胸科医院)、鲁继斌(中国医科大学附属盛京医院)、罗清泉(上海交通大学附属胸科医院)、马冬春(安徽医科大学附属省立医院)、马金山(新疆维吾尔自治区胸科医院)、孟龙(山东大学附属省立医院)、牟巨伟(中国医学科学院北京协和医学院肿瘤医院)、蒲江涛(西南医科大学附属医院)、石彬(北京中日友好医院)、孙大强(天津市胸科医院)、孙克林(中国医学科学院肿瘤医院)、谭群友(陆军军医大学大坪医院)、佟倜(吉林大学第一医院)、涂远荣(福建医科大学附属第一医院)、王群(复旦大学附属上海中山医院)、王长利(天津医科大学附属肿瘤医院)、王建军(华中科技大学同济医学院附属协和医院)、王述民(沈阳军区总医院)、王平(昆明医科大学第二附属医院)、王如文(陆军军医大学大坪医院)、王允(四川大学华西医院)、吴楠(北京大学肿瘤医院)、吴庆琛(重庆医科大学附属第一医院)、冼磊(广西医科大学第一附属医院)、许林(南京医科大学附属肿瘤医院)、徐志飞(海军军医大学附属长征医院)、徐世东(哈尔滨医科大学附属肿瘤医院)、徐刚(遵义医学院附属医院)、徐美青(安徽医科大学附属省立医院)、杨劼(中山大学附属佛山医院)、杨鲲鹏(郑州大学第二附属医院)、喻风雷(中南大学湘雅二医院)、张临友(哈尔滨医科大学附属第二医院)、张铸(新疆医科大学第一附属医院)、张春芳(中南大学湘雅医院)、赵松(郑州大学第一附属医院)、支修益(首都医科大学宣武医院)、朱成楚(浙江省台州医院)、朱余明(同济大学附属上海市肺科医院)
来源:胸心血管外科临床杂志

