WHO最新指南:2019-nCoV相关重症感染临床指南(中文首译版)
点击:858次时间:2020-02-12 11:28:47
引言
本文是WHO在2020年1月28日发布的最新版针对新型冠状病毒的临床指南,是2020年1月12日指南的更新版。
简介
本文适用于指导临床医护人员对院内疑似2019-nCoV感染引起严重急性呼吸道感染的成人和儿童患者实施临床治疗和防护。但本文并不能取代临床医务人员的判断,而是加强对这些患者的临床管理并提供最新指导。在严重急性呼吸道感染(SARI)患者的诊疗中,感染的预防与控制(IPC)以及针对重症患者的优化治疗至关重要。
本文主要分为以下几个章节:
1. 分诊:识别和分类严重急性呼吸道感染(SARI)患者
2. 立即实施适当的感染预防和控制 (IPC)措施
3. 早期支持治疗与监测
4. 采集临床标本用于实验室诊断
5. 低氧性呼吸衰竭和急性呼吸窘迫综合征(ARDS)的管理
6. 感染性休克的管理
7. 并发症的预防
8. 特异性的抗新型冠状病毒(nCoV)治疗
9. 孕妇的特别注意事项
干预符号和说明
(推荐):干预是有益的(强烈推荐)或干预是最佳实践。
(不推荐):已知干预是有害的。
(考虑):干预可能对某些患者有益(有条件的推荐)或在考虑该干预措施时应谨慎。
1. 分诊:识别和分类严重急性呼吸道感染(SARI)患者
分诊:在所有SARI患者首次至医疗单位就诊(比如急诊科)时,临床医生就应对其进行识别和分类。在【表1】所描述的情形下,应考虑nCoV是可能的病原体。分类患者并根据疾病的严重程度启动紧急治疗。
备注:2019-nCoV感染可引起轻度、中度或重度疾病(包括重症肺炎,ARDS,脓毒血症和感染性休克)。尽早识别疑似患者能为及时启动感染预防和控制(IPC)节约时间【详见表2】。对具有严重临床表现的患者【表2】进行早期诊断有利于立即指定和优化支持治疗方案,并根据相关机构或国家规定安全、快速地转入ICU。对于轻度疾病患者,除非担心其病情迅速恶化,否则无需收住院。应要求所有回家观察的患者一旦出现任何恶化表现立即回医院就诊。
表1 疑似2019-nCoV感染的SARI患者定义*

*最新的临床定义请参见https://www.who.int/health-topics/coronavirus
1. 临床医生还应警惕免疫功能低下的患者出现非典型性表现的可能性。
2. 近距离接触定义为:
— 医疗保健相关暴露,包括为nCoV患者提供直接护理,与感染nCoV的医护人员一起工作,探视患者或与nCoV患者处于同一个封闭的环境中;
— 与nCoV患者近距离一起工作或共用同一个室内环境;
— 与nCoV患者一起以任何交通出行方式旅行;
— 与nCoV患者生活在一起。
在所有相关病例中,流行病学联系可能在发病后的14天内发生。
表2 与2019-nCoV感染相关的临床症状

2. 立即实施适当的感染预防
和控制(IPC)措施
IPC是患者临床管理的重要组成部分,应在患者进入医院(尤其是急诊科)就启动。标准预防措施应始终常规应用于卫生保健机构的所有区域。标准预防措施包括:手卫生;使用个人防护装备(PPE)避免直接接触患者的血液、体液、分泌物(包括呼吸道分泌物)和破损皮肤。还包括防止针刺或锋利物品的伤害;医疗废物处理;设备清洁和消毒以及环境清洁。
表3 如何对2019-nCoV疑似或确诊的患者实施IPC

3. 早期支持性治疗与监测
(推荐)对有SARI、呼吸窘迫、低氧血症或休克的患者立即给予辅助氧疗。
备注:以5 L/min的速度开始氧疗并滴定流速,以达到非怀孕成年患者SpO2≥90%和怀孕患者SpO2≥92-95%的目标氧饱和度。儿童有如下症状时(呼吸障碍或停止、严重呼吸困难、中枢性发绀、休克、昏迷或抽搐)应在复苏时接受氧疗使SpO2≥94%; 其他人群达到SpO2≥90%。所有收治SARI的场所均应该配备脉搏血氧计,可运行的供氧系统和一次性使用的氧气输送接口(鼻插管、简易面罩、带储存袋的面罩)。在处理nCoV感染患者受污染的氧气接口时,应做好接触预防措施。
(推荐)对没有休克证据的SARI患者使用保守的输液治疗。
备注:SARI患者应谨慎使用静脉输液,因为激进的补液治疗可能使氧合恶化,特别是在机械通风条件有限的场所。
(推荐)对SARI患者,给予经验性抗微生物药物以治疗所有可能的病原体。对于脓毒症患者,应在初次评估后一小时内给予抗微生物药物。
备注:尽管患者可能怀疑有nCoV,但应在脓毒症鉴定1小时内使用适当的经验性抗生素[17]。经验性抗生素治疗应基于临床诊断(社区获得性肺炎、院内感染肺炎[如果在医疗机构感染]或败血症)、局部流行病学和药敏数据和治疗指南。若存在地方性流行病学史或其他感染相关的危险因素,包括出行史或接触动物流感病毒时,经验性治疗包括使用神经氨酸酶抑制剂治疗流感。经验治疗应根据微生物学结果和临床判断逐步有针对性。
(不推荐)除非特殊原因,否则请勿在临床试验之外常规给予全身性皮质类固醇激素治疗病毒性肺炎或ARDS。
备注:一项对使用糖皮质激素治疗对SARS患者观察性研究的综述发现此疗法无生存益处,并可能存在危害(缺血性坏死、精神病、糖尿病和病毒清除延迟)。另一项针对流感患者的综述表明,使用皮质类固醇会增加死亡和继发性感染的风险但,不过由于适应症的混杂,该循证医学证据被判定为较低。随后的研究通过调整随时间变化的混杂因素解决了这一局限性,结果显示皮质类固醇激素的应用对流感患者死亡率无影响。最近一项对MERS的研究发现皮质类固醇对死亡率没有影响,但延缓了下呼吸道对MERS冠状病毒的清除。由于缺乏有效性且有潜在副作用,除非特殊原因,应避免常规使用皮质类固醇。脓毒症患者如何使用糖皮质激素见第6节。
(推荐)密切监测SARI患者的临床恶化迹象,如迅速进展的呼吸衰竭和败血症,并立即实施支持干预措施。
备注:进行及时、有效、安全的支持治疗是2019-nCoV感染重症患者治疗的基石。
(推荐)了解患者的并发症情况以调整危重症的管理方案,并评估预后。尽早与病人和家属沟通。
备注:在SARI的重症监护诊治期间,应确定哪些慢性治疗应继续,哪些应停止。主动与患者和家属沟通,提供患者的治疗和预后信息。了解患者对维持生命的干预措施的看法和倾向。
4.采集临床标本
用于实验室诊断
世卫组织就标本采集、处理和实验室检测及相关生物安全程序有指导文件[23]。
(推荐)最好在抗微生物治疗之前收集血培养标本以判断引起细菌性肺炎和脓毒症的病原体。勿为收集血培养标本而延迟抗微生物治疗。
(推荐)同时收集上呼吸道(包括鼻咽和口咽)和下呼吸道(包括痰、气管内吸出物或支气管肺泡灌洗液)的标本,通过RT-PCR进行nCoV检测。在下呼吸道样本易于获得的情况下(例如机械通气的患者,临床医生可以选择仅收集下呼吸道样本)。
(推荐)只有当RT-PCR不可用时,才建议进行血清学诊断。
备注:采集标本时应使用适当的PPE(上呼吸道URT样本预防飞沫和接触传播;下呼吸道LRT样本预防空气传播)。当收集URT样本时,使用病毒拭子(无菌涤纶或人造丝,而不是棉花)和病毒运输培养基。不要从鼻孔或扁桃体取样。疑似nCoV的患者,尤指患肺炎或重症疾病的患者,仅URT样本不能排除诊断,建议同时收取URT和LRT样本。相比URT样本,LRT样本更有可能是阳性的,而且持续的时间更长。如果方便的话(如机械通气的病人),临床医生可选择只收集LRT样本。应避免用痰液样本,因为这样会增加气溶胶传播的风险。
备注:在SARS及MERS的案例中,已发现与其他呼吸道病毒感染的双重感染。在这个阶段我们需要对所有疑似病例进行详细的微生物学研究。URT和LRT样本都可以用于检测其他呼吸道病毒,如甲流和乙流(包括人畜共患的甲型流感)、呼吸道合胞病毒、副流感病毒、鼻病毒、腺病毒、肠病毒(如EVD68)、人偏肺病毒和地方性的人冠状病毒(如HKU1、OC43、NL63, 229E)。LRT标本也可用于检测细菌性病原体,包括嗜肺军团菌。
(推荐)在确诊nCoV感染的住院患者中,应重复收集URT和LRT样本以证实病毒清除。标本的采集频率取决于当地情况,但应至少每2-4天收集一次。直到患者出现两个连续的至少间隔24小时的阴性结果(若同时收集URT和LRT样本,需均为阴性),可以看作是临床康复。
5. 低氧性呼吸衰竭和
ARDS的处理
(推荐)当患者出现呼吸窘迫、标准氧疗无效时,应识别严重的低氧性呼吸衰竭。
备注:即使通过储氧袋面罩输送氧气(流速量为10-15 L/min,这通常是维持储氧袋充气所需的最低流量;FiO20.60-0.95),患者仍可能出现持续呼吸次数增加和低氧血症。急性呼吸窘迫综合征(ARDS)中的低氧性呼吸衰竭通常由肺内通气-灌注不匹配或分流引起,通常需要机械通气。
(考虑)高流量鼻导管吸氧(HFNO)或无创通气(NIV)应仅用于特定的低氧血症性呼吸衰竭患者。MERS患者使用NIV治疗的失败风险很高,使用HFNO或NIV治疗的患者应密切监测是否出现临床恶化的情况。
备注1:HFNO系统可输送60L/min的气流和高达1.0的FiO2;儿科设备一般只能达到15L/min,许多儿童需要成人设备才能提供足够的流量。与标准氧疗相比,HFNO减少了插管的需要[24]。高碳酸血症(阻塞性肺病加重、心源性肺水肿加重)、血流动力学不稳定、多器官功能衰竭或精神状态异常的患者一般不应接受HFNO治疗,尽管最新数据表明,HFNO对轻度-中度、无恶化高碳酸血症患者可能是安全的。接受HFNO治疗的患者应密切监护,并由有经验的能进行气管插管的人员进行护理,以防患者在短期试验(约1小时)后出现急性恶化或无改善。关于HFNO的循证指南尚不存在,有关MERS患者的HFNO的研究也很有限。
备注2:NIV指南不推荐用于低氧性呼吸衰竭(心源性肺水肿和术后呼吸衰竭除外)或大流行性病毒疾病(参考SARS和大流行性流感的研究)。NIV风险包括插管延迟、潮气量大和伤害性经肺压。有限的数据表明,MERS患者接受NIV治疗的失败率很高。接受NIV治疗的患者应密切监护,并由有经验的能进行气管插管的人员进行护理,以防患者在短期试验(约1小时)后出现急性恶化或无改善。血流动力学不稳定、多器官功能衰竭或精神状态异常的患者不应接受NIV。
备注3:最近的文献表明,新型的HFNO和NIV系统具有良好的接口,不会造成呼出空气的扩散,因此应该具有较低的空中传播风险。
(推荐)气管内插管应由训练有素和经验丰富的医生使用空气传播预防措施下进行。
备注:ARDS患者,尤其是儿童、肥胖或孕妇,插管过程中氧饱和度可能会迅速降低。用100%的FiO2对带有储氧袋的面罩、袋阀面罩、HFNO或NIV进行预充氧5分钟。经气道评估后如果没有插管困难的迹象,快速插管是合适的。
本节的以下建议适用于机械通气的ARDS患者。这些研究主要针对成年人;也有基于共识的儿童建议。
(推荐)采用较低的潮气量(4-8ml/kg 预测体重,PBW)和较低的吸气量(吸气平台压<30cmH2O)进行机械通气。
备注:这是ARDS患者临床指南的强烈建议,也适用于不符合ARDS标准的脓毒症引起的呼吸衰竭患者。初始潮气量为6ml/kg PBW;当出现不良反应(如不同步,pH <7.15)时,允许使用高达8ml/kg PBW的潮气量。如果pH值达到7.30-7.45,则允许高碳酸血症使用。可以使用呼吸机规程。使用深度镇静剂可用于控制呼吸驱力并达到潮气量目标。虽然与高潮气量或吸气平台压相比,高驱动压力(吸气平台压-PEEP)于ARDS的死亡率更相关36,但尚无针对驱动压力的通风策略的RCT研究。
(推荐)对于严重ARDS患者,建议每天进行大于12小时的俯卧通气。
备注:强烈建议成人和儿童重症ARDS患者采用俯卧通气,但需要足够的人力资源和专业知识才能安全地进行。
(推荐)对无组织灌注不足的ARDS患者采用保守的输液治疗策略。
备注:这是一个强有力的指导性建议,主要作用是缩短换气时间。详细步骤示例参考。
(考虑)对于中度或重度ARDS患者,建议采用高PEEP而非低PEEP。
注:PEEP滴定需要考虑益处(减少肺不张损伤和改善肺泡补充)和风险(吸气末过度膨胀导致肺损伤和更高的肺血管阻力)。根据维持动脉血氧饱和度(SpO2)所需的FiO2,可以使用表来指导PEEP滴定。相关的肺复张术(RMs)表现为高持续气道正压[30-40 cmH2O]的间歇性期,在恒压或高驱动压力下,PEEP逐渐增加;利益与风险的考量是相似的。临床实践指南有条件地推荐较高的PEEP和RMs。对于PEEP,指南考虑了3个RCTs的个体患者数据meta分析。然而,随后的高PEEP和长时间高压RMs的RCT显示有危害,提示应避免该RCT中的方案。建议对患者进行监测,以确定那些对高PEEP初始应用或不同RM方案有反应的患者,并停止对无反应者的干预。
(考虑)对于中度至重度ARDS(PaO2/FiO2 <150)患者,不应常规使用持续静脉输注神经肌肉阻滞药物。
备注:一项试验发现,该策略可改善了重症ARDS患者的生存期(PaO2/FiO2 <150)且不会引起明显虚弱,但最近的一项较大的试验结果发现,使用神经肌肉阻断的高PEEP策略与没有使用神经肌肉阻断的轻镇静策略相比,与生存率并不相关。在某些情况下,仍可考虑对ARDS患者持续的神经肌肉阻滞:使用镇静药物但仍有人机抵抗者,不能可靠地达到潮气量限制;或难治性低氧血症或高碳酸血症。
(考虑)在能够获得体外生命支持(ECLS)专业技术的环境中,肺保护性通气后仍反复低氧血症的患者可以进行转诊。
备注:最近的一份指南没有对ARDS患者的ECLS提出建议。一项关于ARDS患者应用ECLS的RCT研究提前终止,因为研究发现ECLS和标准的医疗处置(包括俯卧位和使用神经肌肉阻滞)相比60天死亡率的主要结果无统计学差异。然而,ECLS与降低死亡组合结局的风险,对这一RCT的事后贝叶斯分析表明,ECLS很可能在一定范围内降低死亡率。在一项队列研究中,ECLS与传统治疗相比,MERS-CoV感染患者的死亡率降低。ECLS应仅在病例数量足够维持专业技术的专业中心提供,并可适用2019-nCoV患者所需的IPC措施。
(不推荐)避免病人于呼吸机断连,以免造成PEEP消失和肺不张。使用直插式导管进行气管抽吸,当需要断开连接时(例如,转移到转运呼吸机)夹紧气管导管。
6. 脓毒性休克的管理
(推荐)成人脓毒性休克确认:当怀疑或确诊感染,且需要血管活性药物来保持平均动脉压MAP>65mm,血乳酸水平>2mmol/l,除外低血容量。
儿童脓毒性休克确认:收缩压SBP低于同龄人第五百分位数或者低于正常值2个标准差)或者符合以下中的2-3条:意识状态改变;心动过缓或过快(婴幼儿:HR<90bpm或HR>160bpm;儿童HR<70bpm或HR>150bpm),毛细血管充盈时间延长(>2秒)或者伴有洪脉的血管舒张;呼吸急促;皮肤花斑或皮疹或紫癜性皮疹;乳酸增加;少尿;体温过高或体温过低。
备注:在缺乏乳酸测量的情况下,使用MAP和临床灌注体征来定义休克。标准治疗包括早期识别和识别后1小时内的以下治疗:抗菌治疗、输液和低血压患者实施升压。中枢静脉和动脉导管的使用应基于资源的可获取性和病人的特定需要。对成人和儿童感染性休克的处理详细指南可参见原文引文。
(推荐)在成年人脓毒性休克中进行复苏时,应在前3小时内给成年人至少注入30ml/kg等渗晶体。对儿童脓毒性休克中进行液体复苏时,快速推注剂量为20ml/kg,在急救时剂量为40-60ml/kg。
(不推荐)前1小时请勿使用低渗晶体,淀粉或明胶进行复苏。
(考虑)液体复苏可能导致容量超载,包括呼吸衰竭。如果对输液无响应或出现了过载迹象(如颈静脉扩张,听诊时有爆裂音,影像学提示肺水肿或出现儿童肝肿大等),应及时减少或停止液体给药。在没有机械通风的场所这一步尤其重要。在资源有限的情况下照顾儿童时,建议使用替代补液疗法。
备注:晶体包括生理盐水和林格氏乳酸盐。根据临床反应和灌注指标改善情况确定是否需要额外的液滴丸(成人250-1000毫升或儿童10-20毫升/公斤)。灌注目标包括MAP(儿童为>65mmHg或适龄目标)、尿量(成人为>0.5 ml/kg/hr,儿童为1ml/kg/hr)以及皮肤花斑、毛细血管再充盈、意识水平和乳酸的改善。基于当地资源和经验,在初步液体复苏后,考虑容量反应的动态指数来指导后续的液体输注。这些方法包括被动抬腿、连续搏动量测量,收缩压的动态变化,脉压和下腔静脉宽度,机械通气过程中胸腔内压力变化对容量的影响。
与晶体相比,淀粉会增加死亡和急性肾脏损伤的风险。明胶的作用不清楚,但是价格高于晶体液。低渗溶液(相对于等渗溶液)在增加血管内容量的方面效果较差。拯救脓毒症运动建议当病人需要大量晶体时白蛋白可以用于复苏,但这个条件性建议是基于低质量的证据。
(推荐)在液体复苏后仍存在休克,应使用升压药。初始血压目标是MAP成人≥65mmHg或适合儿童年龄的目标。
(考虑)如果没条件放置中央静脉导管,血管升压药可以通过外周静脉给药,但要使用大静脉并监测渗出和局部组织坏死的迹象。如有渗出,应停止输液。抗利尿激素也可以通过骨内针注射。
(考虑)如果灌注不良和心功能障碍的迹象持续存在,即使通过液体和血管升压剂达到目标MAP,也要考虑强心剂如多巴酚丁胺。
备注:抗利尿激素(即去甲肾上腺素、肾上腺素、血管加压素和多巴胺)通过中枢给药最安全。并严格控制给药速度,但也有可能通过外周静脉注射或骨内针注射。经常监测血压,将血管加压素滴定到维持灌注所需的最低剂量以防止副作用。去甲肾上腺素是成人患者的首要用药;也可以添加肾上腺素或血管加压素来达到目标MAP。由于存在快速心律失常的风险,应将多巴胺储备给特定的低速心律失常风险的患者或者那些有心动过缓的人。在患冷休克的儿童中(较常见),肾上腺素被认为是一线用药,而去甲肾上腺素则用于温休克患者(较少见)。
目前尚无随机对照试验比较多巴酚丁胺和安慰剂的临床效果。
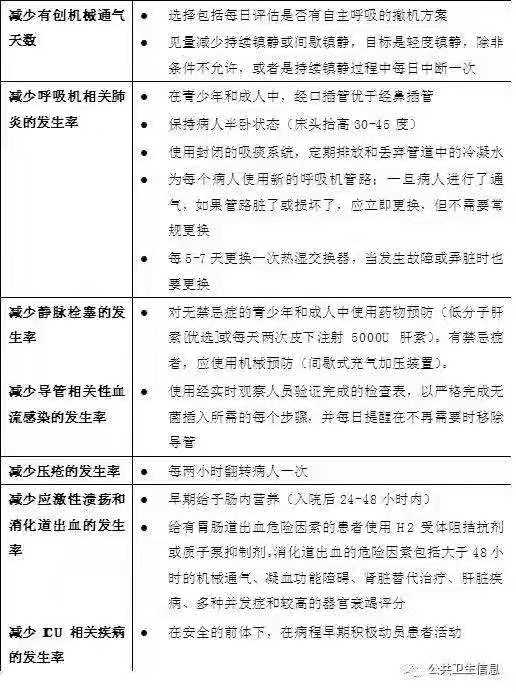
7、并发症的预防
实施下列干预措施【表4】,以预防与危重症相关的并发症。这些干预措施是基于拯救脓毒症运动指南或其他指南,通常限于基于高质量证据的可行建议。
表4 并发症的预防
8、特异性抗新型冠状病毒
治疗和临床研究
(考虑)目前没有RCT研究的证据支持特异性抗新型冠状病毒治疗疑似或确诊病例。
(推荐)未经许可的治疗应仅在经过伦理批准的临床试验或未经注册的干预措施框架(MEURI)的监测下进行,并进行严格的监测。https://www.who.int/ethics/publications/infectious-disease-outbreaks/en/
(推荐)可在世卫组织2019年nCoV网站上获得临床特征描述方案:https://www.who.int/emergencies/diseases/novel-coronavirus-2019.世卫组织建立了全球2019-nCoV临床数据平台供会员国共享。如有其他问题请联系EDCARN@who.int。
9、妊娠患者特别注意事项
(推荐)对于疑似或确诊2019-nCoV的孕妇需要按上述推荐方案治疗,同时兼顾考虑妊娠的生理性因素。
(推荐)在使用探索性治疗方案时,需按个体利弊分析,基于母亲潜在的获益和胎儿的安全性,并咨询产科专家和伦理委员会。
(推荐)紧急分娩和终止妊娠的决定基于多个因素:孕龄、母亲的状况、胎儿的稳定性。必须咨询产科、新生儿科和ICU的专家(视母亲情况)。
10、致谢
该文件的最初版本是在与国际急症护理试验专家论坛(InFACT)、ISARIC和拯救脓毒症运动的协商下制定的。以下人员对当前版本进行了贡献或审阅。收集和审查了机密性和利益声明。
WHO:April Baller, Janet Diaz, Dina Pfeifer, Maria Van Kerkhove, Satoko Otsu,Richard Peabody.
Non-WHOexperts: Neill Adhikari, Sunnybrook Health Sciences Centre and University ofToronto; Yaseen Arabi, King Saud Bin Abdulaziz University for Health Sciences,Saudi Arabia; Kenneth Baillie, University of Edinburgh, UK; Gail CarsonUniversity of Oxford, ISARIC; Charles David Gomersall The Chinese University ofHong Kong; Jake Dunning, Public Health England, UK; Rob Fowler, University ofToronto, Canada; Susan Gerber, Centers for Disease Control and Prevention, USA;Frederick Hayden, University of Virginia, USA; Peter Horby University ofOxford, ISARIC; David Hui, Chinese University of Hong Kong, Hong Kong SAR;Yae-Jean Kim, Sungkyunkwan University, Samsung Medical Center, Korea; SrinivasMurthy, University of British Columbia, Canada; Norio Ohmagari, M.D., M.Sc.,Ph.D, WHO Collaborating Centre for Prevention, Preparedness and Response toEmerging Infectious Diseases, National Center for Global Health and MedicineHospital Toyama, Tokyo Japan; Yinzhong Shen Shanghai Public Health ClinicalCenter, Fudan University(沈银忠 复旦大学附属上海市公共卫生临床中心);Naoki Shimizu; Tim Uyeki, Centers for Disease Control and Prevention, USA.

