全球首次系统绘制成年人心脏单细胞图谱!Nature子刊发表阜外医院胡盛寿院士团队文章
点击:2144次时间:2020-04-02 11:04:16
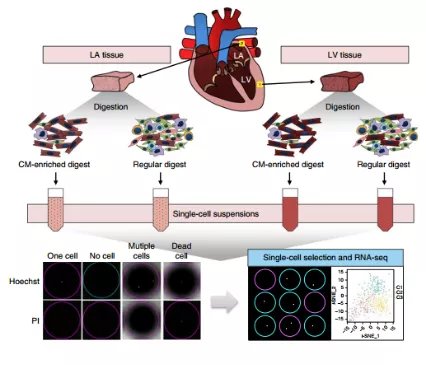
近期,中国医学科学院阜外医院胡盛寿院士、王利教授团队成功实现了人类心肌细胞的高通量捕获。
研究通过对21 422个心脏组织细胞进行单细胞测序和分析,在世界上首次系统绘制了成年人心脏的单细胞图谱。论文发表在Nature Cell Biology上。

现代生物学研究已经进入到了单细胞乃至单分子的时代。细胞生物学的研究达到了前所未有的分辨率,最终目标是绘制完整的单细胞图谱。
绘制单细胞图谱的前提是能够高质量、高通量地分离出单个细胞。目前,在哺乳动物及人的多个器官内如神经、血液、肺、肝脏、胰腺等,已经开展了单细胞图谱的大规模绘制工作。
但心脏系统中还只有零星的几个小规模研究。其主要原因是成体心肌细胞体积大(长杆状,长100-150 μm, 宽20~30 μm), 远超过常规体细胞(近球形,直径<30 μm)。目前主流的商用单细胞平台都难以捕获此类大细胞。
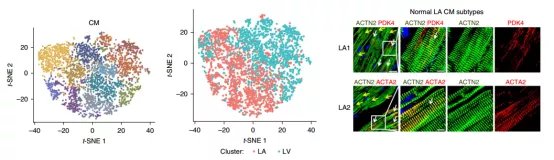
研究人员首先对来自左心房和左心室组织的细胞进行了比较。有意思的是,非心肌细胞在心房、心室组织没有显著差异,而心肌细胞则表现出显著差异。
心房CM细胞高表达收缩相关基因MYH6、MYL4、MYL7、TNNI1等,而心室CM细胞则高表达另外一组基因MYH7、MYL2、MYL3、TNNI3等。
另外心房CM细胞相对高表达大量分泌蛋白(如NPPA、NPPB、DKK3等)和膜蛋白(如PAM、KCNJ3、KCNK1等),这提示心房组织可能通过旁分泌作用对心脏发挥重要调节功能。
通过对转录因子调控网络的分析,预测转录因子HSF2可能特异调控心房CM细胞基因表达,而EGR1、NFIL3则可能特异调控心室CM细胞的基因表达。
通过进一步聚类分析,心房和心室CM细胞又各可以分为五个亚类(Subtype),分别表达特异的marker基因及参与特定生物学过程。
这一现象提示心肌细胞有很大的异质性,打破了常规认为只有一种心肌细胞的观点,对了解心脏功能及未来精准治疗都有很大的价值。
另外,还发现了一种高表达SMARCA4基因的特殊心肌细胞,这种细胞具有跨心房、心室分布的特点,并且其中心肌主要marker基因如TNNT2、MYH6、MYH7的表达水平都极低,推测这可能是正在发生功能退化的心肌细胞。
在系统比较心肌细胞后,研究人员又对三类主要的非心肌细胞:内皮细胞,成纤维细胞,巨噬细胞进行了亚型鉴定,并且根据细胞特异表达的分泌蛋白及膜蛋白,预测了整个心脏组织内的Cell-Cell Interaction Network。
其中一种高表达ACKR1基因的内皮细胞很有意思,在心室组织内它与其它细胞类型预测有数量最多的相互作用,提示它可能是一种重要的调节性细胞。
绘制正常心脏组织单细胞图谱后,研究团队利用阜外医院特有的临床资源,对扩张型和肥厚型两种心肌病开展了单细胞比较研究。
在心肌细胞内发现两种疾病有各自独特的表达模式:扩张型高表达如NPPA、NPPB、DKK3、MSRB3等,而肥厚型则表达S100A6、PDK4、NEAT1等。
这些基因可能作为临床分型的候选基因;通过对转录调控网络分析,预测了多个在肥厚型和扩张型心肌病中特异高表达的转录因子基因,可能作为候选治疗靶点。
尤为有意思的是,先前发现的ACKR1+内皮细胞,在两种疾病中细胞数量都出现显著下降,推测这种细胞的缺失可能导致疾病发生。
为了验证这一点,研究者利用心衰模型的小鼠,在心脏注射ACKR1+内皮细胞,结果显著改善心脏功能。这提示这一细胞类型具有潜在的临床治疗价值。
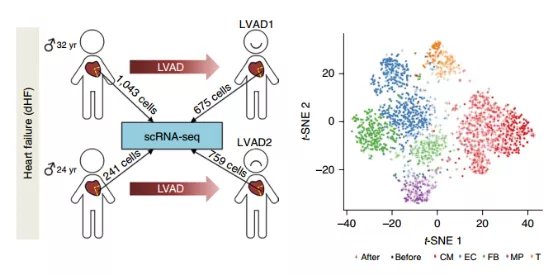
研究者还开展了一项临床相关研究工作。安装左心室辅助器 (LVAD)是一种常见的心衰治疗手术。但有些患者接收手术的治疗效果不佳,其中原因还不明确。通过采集两例患者(一例术后心脏功能恢复良好,一例不佳),进行单细胞测序比较。
研究者以正常心脏的单细胞做为参照,比较LVAD前后各种细胞与正常细胞的相似水平,定义了一个手术效果衡量指标,恢复系数。术后恢复良好病人的心肌细胞和非心肌细胞的恢复系数都显著好于不佳患者。
该系数可用于以后类似研究的评估工作。通过比较两例病人和正常人心肌细胞的表达谱,发现术后差的病人有一簇特异高表达的基因,可能作为治疗的靶点。并且术后良好的患者在某些基因如protein refolding相关基因的表达水平也还低于正常水平,也提示有进一步改善的可能。
该研究工作首次系统性开展了人成体心脏细胞的单细胞图谱绘制工作,并开展了疾病机制研究,为世界心血管疾病研究同行提供了一份宝贵的基础研究资源。
该研究在胡盛寿院士指导下展开,由胡盛寿院士团队和王利教授团队共同完成。该论文第一作者为王利、于鹏、周冰莹和宋江平,通讯作者为胡盛寿院士。研究得到了阜外医院心脏移植中心和心血管疾病国家重点实验室的大力支持。
来源:Wang L, Yu P, Zhou B, Song J. & Li Z. et al. Single-cell reconstruction of the adult human heart during heart failure and recovery reveals the cellular landscape underlying cardiac function. Nature Cell Biology 22, 108–119; 10.1038/s41556-019-0446-7 (2020).

