先天性心脏病外科治疗中国专家共识(三):肺动脉闭锁合并室间隔缺损
点击:155次时间:2020-06-22 15:08:11
陈欣欣1,李守军2 代表国家心血管病专家委员会先天性心脏病专业委员会
1. 广州市妇女儿童医疗中心 心脏中心(广州 510000);2. 中国医学科学院阜外医院 小儿外科中心(北京 100037)
通信作者:陈欣欣,Email:zingerchen@163.com;李守军,Email:drlishoujun@yahoo.com
关键词:外科治疗;先天性心脏病;肺动脉闭锁;肺血管单源化;专家共识
引用本文:陈欣欣,李守军代表国家心血管病专家委员会先天性心脏病专业委员会. 先天性心脏病外科治疗中国专家共识(三):肺动脉闭锁合并室间隔缺损. 中国胸心血管外科临床杂志, 2020, 27(4):401-407. doi: 10.7507/1007-4848.202002040
正 文
肺动脉闭锁合并室间隔缺损(pulmonary atresia with ventricular septal defect,PA/VSD)是一类较为复杂的先天性心脏畸形。据报道 1 000 位活产婴儿中有 0.07 例患有 PA/VSD,约占先天性心脏病患儿的 1%~2%[1]。其不同类型各具特点,诊断和治疗方法尚不完全统一,治疗效果参差不齐[2]。国内病例中大龄患儿比例高[3],其它社会因素也增加了该病治疗的复杂性。因此,我们根据文献提供的循证资料和专家意见,制定该专家共识,力争逐步完善 PA/VSD 的外科治疗方案。
1 方法与证据
本共识检索 MEDLINE、The Cochrane Library、万方数据库等,回顾性分析从 2020 年 1 月回溯近 30 年关于 PA/VSD 的文献和专著,通过专家讨论结果筛选存在争议的调查项目,根据文献提供的循证资料和专家讨论意见,最终形成以下共识。
1.1 共识采用的推荐级别
Ⅰ 类:已证实和/或一致公认有效,专家组有统一认识;Ⅱa 类:有关证据/观点倾向于有用或有效,应用这些操作或治疗是合理的,专家组有小争议;Ⅱb 类:有关证据/观点尚不能被充分证明有用或有效,但可以考虑使用,专家组有一定争议;Ⅲ 类:已证实和/或公认无用或无效,不推荐使用。
1.2 共识采用的证据水平
A:数据来源于多中心随机对照试验或 Meta 分析或大型注册数据库;B:数据来源于单个随机对照试验或非随机研究;C:数据仅来源于专家共识或病例报告。
2 定义及分型
PA/VSD 命名仍有争论,尚不完全统一。虽然众多文献仍采用法洛四联症合并肺动脉闭锁的说法[4-6],但大多数人主张“肺动脉闭锁合并室间隔缺损”这一名称。其主要包括两个解剖畸形:一是非限制性对位不良室间隔缺损,二是肺动脉瓣亦或肺动脉干闭锁。再根据肺血来源和肺动脉发育情况分型[7]。对于有粗大侧枝血管(major aortopulmonary collateral arteries,MAPCAs)者命名为肺动脉闭锁/室间隔缺损/粗大体肺侧枝血管(PA/VSD/MAPCAs)(Ⅱa C)。本共识不讨论合并心房、心室或大动脉连接不一致的心脏畸形以及合并功能性单心室的心脏畸形。
Tchervenkov[7] 、Barbero-Marcial[8] 、Castaneda 等均报道了 PA/VSD 的分型方法。后两者是常用的命名方法。国内较常用 Castaneda 命名方法:Ⅰ 型,单纯肺动脉瓣闭锁或漏斗部闭锁,肺循环依赖动脉导管;Ⅱ 型,主肺动脉闭锁,左右肺动脉有汇合部,肺循环依赖动脉导管;Ⅲ 型,固有肺动脉发育不良或发育尚可,存在多发体-肺动脉侧枝血管,肺循环不依赖动脉导管;Ⅳ 型,固有肺动脉缺如,肺循环全部血供来源于体-肺侧枝血管。因为 Ⅰ 型和 Ⅱ 型 PA/VSD 在治疗策略上基本相同,国际上使用 Tchervenkov 分型较为普遍。本共识亦采用该分型方法。其分型如下:A 型,包括上述的 Ⅰ 和 Ⅱ 型,肺循环依赖动脉导管,有固有肺动脉,无大的体-肺侧枝血管;B 型,同 Ⅲ 型,固有肺动脉发育不良,存在粗大体-肺侧枝血管;C 型,同 Ⅳ 型,固有肺动脉缺如,肺循环全部血供来源于体-肺侧枝血管。
3 诊断学检查
PA/VSD 的诊断学检查,除了常规的理化检查,最主要的是要明确心内畸形、生理功能、肺动脉和侧枝血管的发育和分布情况。
3.1 心脏超声
心脏超声是 PA/VSD 的常规检查,可以较准确地评估心内畸形及生理功能;评估肺动脉发育情况;结合多普勒血流图也可以评估肺血供情况。其局限性在于对多发侧枝血管的评估准确性较差[9](ⅠC)。
3.2 多排 CT
多排 CT 是 PA/VSD 的常规检查,可以明确固有肺动脉发育情况、侧枝血管数量、起源以及形态特点[4, 10-11]。术前可根据 CT 数据生成 3D 图像,亦可打印成模型,协助诊断[12]。可分辨体肺侧枝血管与气管和食管的解剖关系,为手术提供有利的信息。其不足之处在于对计算侧枝血管具体供应肺段的数量、判断固有肺动脉和侧枝血管的交通情况不够准确(ⅠC)。
3.3 心导管检查
心导管检查是 B/C 型和肺动脉发育不良的 A 型 PA/VSD 的常规检查。心导管造影可以更直观地展示侧枝血管数量、起源和分布(ⅠC)。(1)若造影图像上出现特有的“海鸥”(seagull)征[13],可以明确为固有肺动脉,排除 C 型 PA/VSD。(2)明确固有肺动脉和侧枝血管在各肺段的分布以及固有肺动脉和侧枝血管交通情况。(3)计算固有肺动脉和侧枝血管灌注肺段的数量。(4)计算总的新肺动脉指数(total neopulmonary arterial index,TNPAI),即固有肺动脉和拟行肺血管单源化术的侧枝血管的横截面积之和(mm2)除以体表面积(m2)[14] (ⅠB)。
3.4 磁共振血管造影
磁共振血管造影(MRA)是一种较为准确地描绘 PA/VSD 患者肺血供所有来源的诊断技术,被认为是非侵入性替代 X 线血管造影的方法[15-17];也能够分辨体肺侧枝与气管和食道的解剖关系。因为该检查要求患儿保持不动,检查时间较长,所以需要患儿全身麻醉,国内使用尚未普及(ⅠC)。
3.5 基因检测
目前认为大多疾病都有其遗传学基础,检测出相关基因有异常可对早期诊断和判断预后有重要指导意义。如 22q11 微缺失综合征,在 PA/VSD 患儿中有较高的发生率,预后也相对较差[18-19](ⅠB)。
4 手术适应证及手术时机
4.1 A 型 PA/VSD 患儿
A 型 PA/VSD 患儿的肺动脉血流依赖于动脉导管的开放。动脉导管的直径和肺动脉发育情况不同,动脉血氧饱和度(SaO2)也会有差异。SaO2<75% 或>90% 被认为是新生儿期手术的指征[20](ⅠC)。动脉导管趋于关闭时新生儿期即会出现严重缺氧、代谢性酸中毒,需要前列腺素 E 维持动脉导管开放。此类患儿动脉血氧饱和度往往<75%,新生儿期即应行手术治疗[21-23] (ⅠC)。对 SaO2>90% 的患儿我们推荐 1~3 个月行手术治疗。其他患儿也应该在 3~6 个月内行手术治疗[24](Ⅱa C)。肺动脉发育良好的患儿可行一期矫治术(即同时关闭室间隔缺损)(ⅠC)。
一期矫治术的手术适应证包括:(1)术前 McGoon 指数≥1.2~1.5(ⅠC);(2)术前 Nakata 指数≥150 mm2/m2(ⅠC);(3)术中肺动脉流量试验(flow study):对于肺动脉条件较为临界的患儿,可采用该方法。即当肺动脉灌注流量达到 3 L/(min·m2),肺动脉平均压≤25 mm Hg 时,可关闭室间隔缺损[25-26](Ⅱa B)。其具体操作详见 5.5。
不满足一期矫治手术适应证时,可行右心室肺动脉连接术或体肺动脉分流术[21, 27]。对于新生儿及<3 个月的小婴儿建议行体肺分流术,可避免体外循环;对于大龄婴儿建议行右心室肺动脉连接术,有利于促进肺动脉发育(Ⅱa C)。
4.2 B/C 型 PA/VSD 的外科治疗
目前文献报道较多的是 B/C 型 PA/VSD 的外科治疗,争议也较大,但早期治疗是趋势。Watanabe 等[24]报道的中位手术年龄是 5 周,有 1/4 患儿伴有充血性心功能不全。Soquet 等[28]报道首次姑息手术中位年龄是 3.3 周,一期矫治手术中位数年龄是 8.6 个月。制定规范的程序化手术治疗策略是对 B/C 型 PA/VSD 管理的有效方法,有利于改善预后[24]。手术治疗策略是促进固有肺动脉发育和侧枝血管单源化(包括交通侧枝血管的结扎或封堵、侧枝血管与侧枝血管的吻合、侧枝血管与固有肺动脉的吻合),最终完成 PA/VSD 矫治术。Reddy 等[29]报道 2/3 以上患儿可以早期一期矫治。满足以下指征可考虑行一期矫治手术:(1)术前 TNPAI(计算方法见 3.3)≥150 mm2/m2(ⅠB);(2)肺血管单源化以后,超过 75% 肺段由中央肺动脉灌注(Ⅱa C);(3)肺血管单源化以后,消除了分支血管狭窄(ⅠC);(4)术中 flow study(具体操作见 5.5):肺血管流量 3 L/(min·m2)时,平均肺动脉压≤25 mm Hg(Ⅱa B);(4)术前 SaO2≥85%(Ⅱa C)。
4.3 B/C 型 PA/VSD 的手术时机
B/C 型 PA/VSD 的手术时机取决于固有肺动脉和侧枝血管的发育和分布情况。根据术前 SaO2,可分为三种亚型:肺少血型(SaO2<75%),肺血平衡型(SaO2 介于 75% 和 90% 之间)和肺多血型(SaO2>90%)[20]。
4.3.1 肺少血型
此类患儿缺氧明显,往往肺动脉和侧枝血管发育较差,应于新生儿期或婴儿早期手术治疗,行体-肺动脉分流术。3~6 个月后再次评估,未达到二期矫治术条件者行右室肺动脉连接术或再次体-肺分流术(改用更大直径的分流管道)。对于固有肺动脉直径>2.5 mm 者,首选右室肺动脉连接术(Ⅱa C)。
4.3.2 肺多血型
此类患儿早期出现充血性心力衰竭。全面评估后,达到矫治适应证者,3~6 个月行一期矫治术,包括 C 型 PA/VSD 患儿(ⅠC)。
4.3.3 肺血平衡型
患儿耐受性较好。固有肺动脉和侧枝血管发育情况变异较大。满足矫治条件的可选择 6~12 个月行一期矫治术(ⅠC)。不满足条件者 1~3 个月行姑息手术促进肺动脉发育。对于固有肺动脉直径≤2.5 mm 者,行 Melbourne 分流术或其它类型的体肺分流术[25](见 5.1)。固有肺动脉直径>2.5 mm 者行右室肺动脉连接术(Ⅱa C)。术后定期复查评估,参考一期矫治手术适应证,达到条件者可行矫治术。国外文献报道,对于无固有肺动脉的 C 型患儿,且未到达矫治条件者,亦可行肺血管单源化术,再在新肺动脉和主动脉间行中央分流术[20]。但在国内对此种亚型的 PA/VSD 处理比较谨慎(Ⅱa C)。
4.3.4 术后评估
第一期手术后 1~6 个月行心导管检查,评估固有肺动脉发育和侧枝血管变化情况。对狭窄的肺动脉及侧枝血管行球囊扩张术,促进肺动脉的持续发育[30] (ⅠC)。
5 手术方法
5.1 体肺分流术
5.1.1 改良 B-T 分流术(ⅠC)
右锁骨下动脉和右肺动脉间用聚四氟乙烯(ePTFE)血管连接。新生儿期可选择直径 3.5~4.0 mm 血管,婴儿期可选择 4~6 mm 血管连接。术中充分游离右肺动脉和右锁骨下动脉,避免管道或肺动脉扭曲。新生儿期或可保留动脉导管,术后血流动力学更加稳定[31]。
5.1.2 中央分流术(ⅠC)
中央分流术是 B/C 型 PA/VSD 体肺分流的首选术式。经典方法是以 ePTFE 血管连接主肺动脉和升主动脉。也可将主肺动脉直接吻合于升主动脉[20, 25, 32],也称作 Melbourne 分流[33-34] (图 1)。目前较多采用其改良术式(图 2)。ePTFE 血管与升主动脉侧侧吻合被认为更有利于保持管道通畅以促进肺动脉发育[35]。C 型 PA/VSD 则是肺血管单源化术后,新肺动脉和升主动脉间行中央分流术[20]。术中须注意防止肺动脉扭曲。
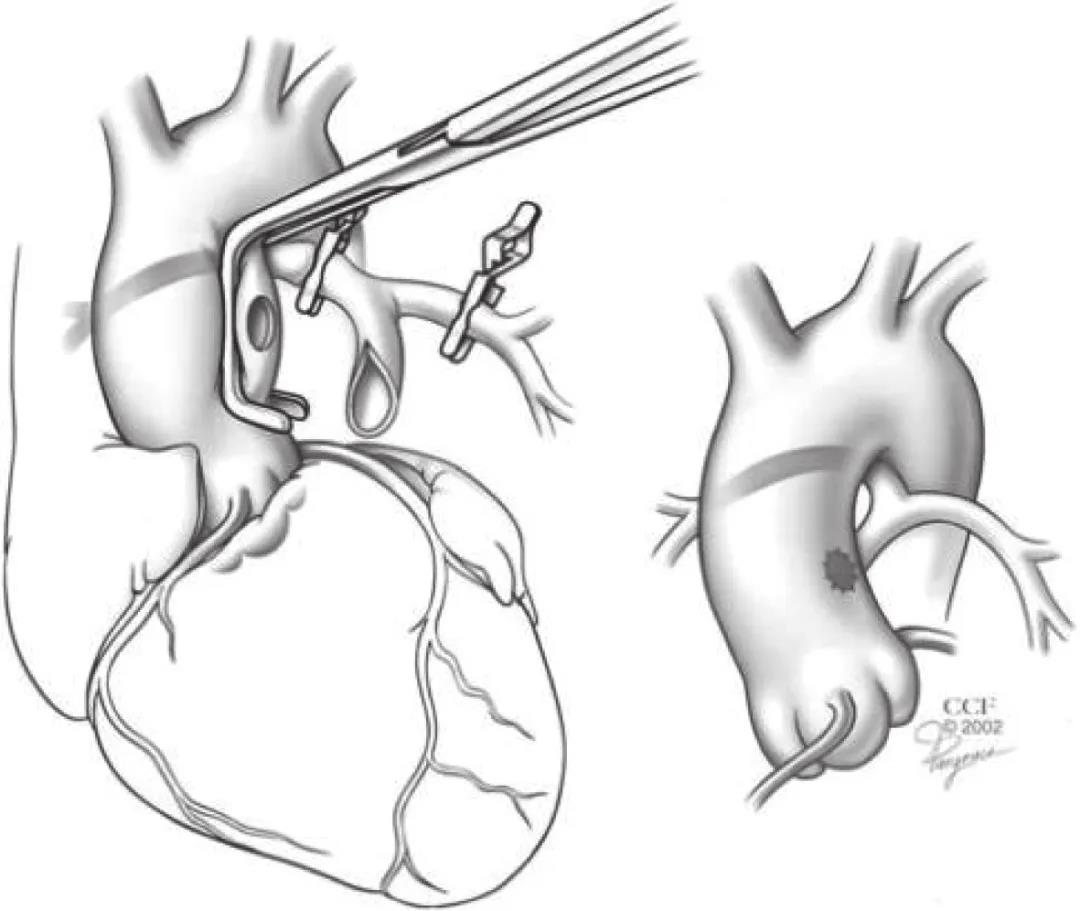
图1 Melbourne 分流术
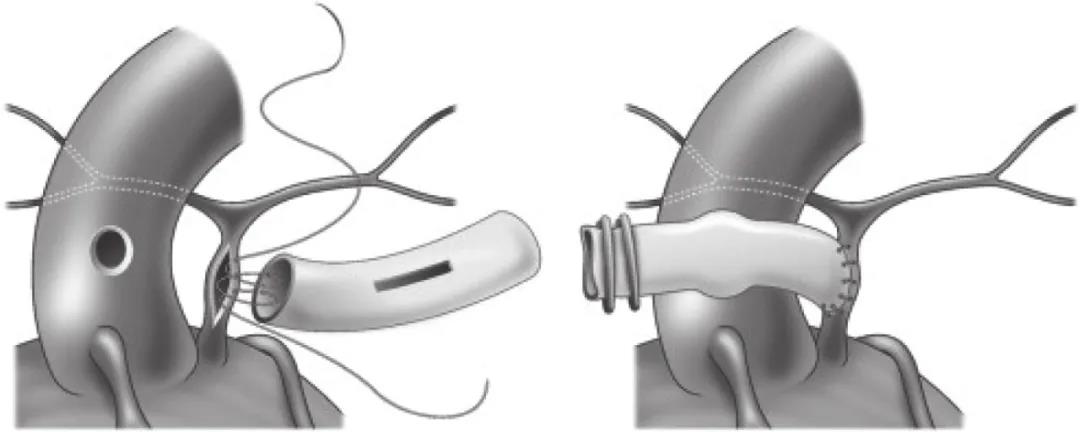
图2 聚四氟乙烯血管-升主动脉侧侧吻合的中央分流术
5.2 右室肺动脉连接术
以人工血管或补片建立右室肺动脉的连续性[30, 36]。
5.2.1 手术方法
手术方法是先游离固有肺动脉,在常温或浅低温体外循环支持下,将人工血管远心端先与固有肺动脉汇合部吻合,再将人工血管近心端后壁吻合于右室流出道,心脏不停跳情况下切开右室流出道,边吸引右室内血液边缝合剩余前壁部分切口。术中注意保持头低位,小心吸引,防止左心进气(ⅠC)。
5.2.2 切口
对于主肺动脉与右室流出道有连续的,在常温或浅低温体外循环支持下,纵行切开主肺动脉和右室漏斗部,以 0.6% 戊二醛处理的自体心包补片扩大修补该切口(Ⅱb C)。
5.2.3 管道选择
管道可以选择同种带瓣管道、异种带瓣管道、自体心包管道或人工合成管道。其中自体心包管道较容易获取,通畅率高,临床效果与其他管道相似[3, 37],可适当选用。目前常用的异种带瓣管道是带瓣牛颈静脉,产品种类少,仅适用于部分患儿。人工合成管道如 ePTFE 血管,吻合口和针眼相对容易出血,可根据具体条件适当选择(ⅠC)。
5.2.4 带瓣管道
在行矫治术时,右室肺动脉连接尽量选用带瓣管道,如带瓣牛颈静脉、手工缝制瓣膜的 ePTFE 带瓣管道[38]或同种带瓣管道(ⅠC)。
5.2.5 管道直径的选择(Ⅱb B)
对于姑息性右心室肺动脉连接,管道直径的选择可参考以下公式:管道直径(mm)=0.325×体重(kg)+4.629[3]。对于矫治术的右心室肺动脉连接管道直径选择见表 1。

表1 体重-管道直径对照表
5.3 侧枝及肺动脉的处理
对于侧枝血管的处理,争议比较大。因随着年龄增长,侧枝血管在 3~6 个月可能出现不同程度的血管病变、狭窄。现有两种观点:促进固有肺动脉发育(rehabilitation)策略[32, 39]和体肺侧枝单源化(unifocalization)策略[29, 40]。合理的治疗方案应根据患者的个体化特征来制定。
5.3.1 经皮介入封堵
对于和固有肺动脉有充分交通的侧枝血管可在 X 线透视下进行封堵术[36]。如术前预计侧枝血管较粗,封堵术后对 SaO2 影响较大者,建议在 Hybrid 手术时实施侧枝血管封堵术(ⅠC)。
5.3.2 术中结扎侧枝血管
正中或侧位开胸,游离侧枝血管,明确有交通的侧枝血管,予以结扎或以血管夹夹闭(ⅠC)。
5.3.3 肺血管单源化
将发自主动脉及其分支的 MAPCAs 连接于固有肺动脉或新建肺动脉上。此手术较为复杂多变,随 MAPCAs 起源、走行、形态不同而不同,没有固定术式。除 C 型 PA/VSD 外,肺血管单源化不作为首次姑息手术的首选术式(Ⅱa C)。术中应尽量利用具有良好弹性的自身组织直接吻合。游离困难、距离较远的侧枝血管也可以采用人工血管连接。手术入路首选胸骨正中切口;如果侧枝血管起源位置在第 7 胸椎以下,游离比较困难,也可选择侧位切口(ⅠC)。术中应先在非体外循环下充分游离出固有肺动脉和侧枝血管,然后在体外循环下进行吻合,选择 8/0 或 7/0 缝线连续严密缝合,防止出血。术中应彻底解除侧枝血管的狭窄,如 MAPCAs 起始部有狭窄时,应游离至肺门处无狭窄段(ⅠC)。
5.3.4 左右固有肺动脉的处理
如固有肺动脉近中段狭窄时,需补片扩大至肺门处无狭窄段(ⅠC)。
5.4 室间隔缺损的处理
当术前很难判断能否关闭室间隔缺损时,肺动脉流量试验(flow study)为术中判断是否关闭室间隔缺损提供了较好的依据(Ⅱa B)。当肺动脉灌注流量达到 3 L/(min·m2),平均肺动脉压≤25 mm Hg 时,可关闭室间隔缺损。否则应在室间隔补片开窗。开窗面积以 0.8 cm2/m2为参考值,有利于维持术后循环状态稳定(Ⅱa C)。
停体外循环后直接测量右心室和左心室压,该类患儿往往不存在左室流出道梗阻,可用主动脉收缩压代替左心室收缩压。计算右心室和主动脉收缩压比值,也是判断室间隔补片是否需要再开窗的重要监测方法。右心室收缩压/左心室收缩压>0.75,需要大剂量血管活性药物支持(血管活性-正性肌力药评分>20)[41-42]或者循环不稳定的情况下,需要再次体外循环转流行室间隔补片开窗术(ⅠB)。
血管活性-正性肌力药评分=多巴胺[mcg/(kg·min)]×1+多巴酚丁胺[mcg/(kg·min)]×1+米力农[mcg/(kg·min)]×1+肾上腺素[mcg/(kg·min)]×100+去甲肾上腺素[mcg/(kg·min)]×100+血管加压素[units/(kg·min)]×10 000。
5.5 肺动脉流量试验
肺动脉流量试验(flow study)是在肺动脉承担正常心输出量的情况下,通过测量肺动脉平均压,来评估肺血管阻力的方法。在肺血管单源化术后,在主肺动脉置入肺动脉灌注管并套锁,在主肺动脉插入测压管连接换能器测量肺动脉压力(图 3)。扩大房间隔切口用两根引流管进行充分左心房引流。灌注开始前吸走左右胸腔可能的积血,正压气囊通气,避免肺不张,呼吸机保持正常潮气量和频率[14, 26, 43] 。肺动脉灌注流量从 0.5 L/(min·m2)开始,逐步升高到 3 L/(min·m2),并保持 30 s,稳定后记录肺动脉压力。
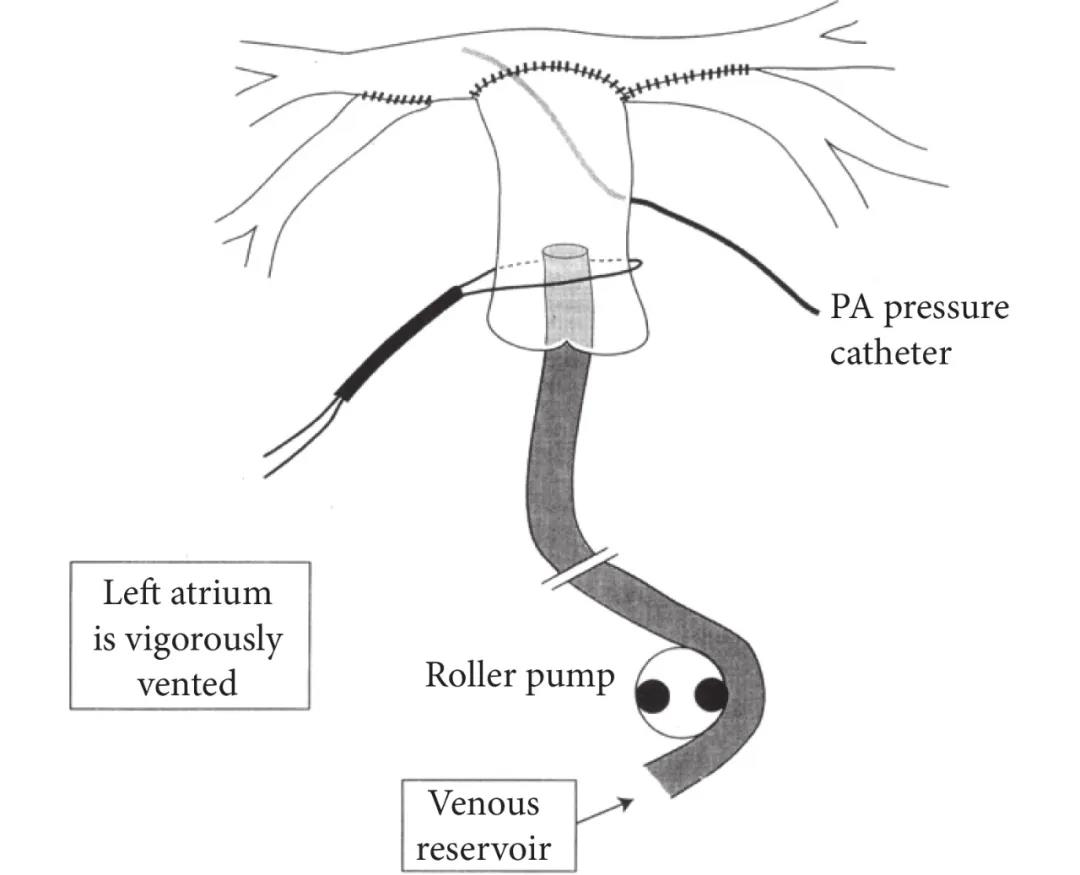
图3 肺动脉流量试验操作示意图
6 并发症及防治
手术主要并发症有手术创面出血、肺出血、术后感染、消化道出血、低心排血量综合征、膈肌麻痹、迷走神经损伤、乳糜胸及延迟关胸等。在各种先天性心脏病手术中,前 4 种并发症在 PA/VSD 矫治术中更容易出现(Ⅱa C)。术中须仔细操作,尽量在肝素化前完成游离工作,并彻底止血。切除纵隔淋巴结时,仔细辨认神经和淋巴组织,防止损伤,有淋巴液渗漏时及时缝扎。术中左房引流较多时,应降温、降流量,并仔细探查和回顾术前影像资料,防止遗漏侧枝血管。
6.1 手术创面出血
吻合口较大量的出血并不常见。纵隔内广泛侧枝血管及淋巴结滋养血管出血是主要原因。特别是多次手术患儿创面出血容易反复,电凝烧灼止血的焦茄容易脱落,所以止血方法应以缝扎或钛夹夹闭为主,在肝素化前确保没有活动性出血(Ⅱa C)。术中肺血管单源化吻合口采用 8/0 或 7/0 聚丙烯缝线缝合会减少吻合口出血的机会,缩短止血时间。术中常规使用血液回收机,应积极补充凝血因子,必要时输注血小板。出血难以控制时,需要压迫止血并延迟关胸(ⅠC)。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)所需的抗凝要求低,血液破坏较体外循环更少;静脉-动脉插管(V-A)模式可降低左右心室前负荷,降低中心静脉压和肺动脉压,而减少出血。所以在出血难以控制的情况下,可考虑行 ECMO 辅助(Ⅱb C)。
6.2 肺出血
肺出血是比较严重的并发症,可出现于术中或术后数日。术中及术后早期出血,予延长呼吸机辅助时间,提高呼气末正压(PEEP)或改用高频震荡呼吸机辅助通气(ⅠB)。如出血情况不能控制,须尽快行心血管造影检查,封堵出血血管(ⅠC)。
6.3 术后感染
术后感染是常见并发症。手术时间越长,输血越多,感染率越高。术后延迟关胸、肺出血、ECMO 辅助均会增加感染风险。围术期常规应用二代头孢菌素预防感染。术后发热、炎症指标升高需及时升级抗生素;同时行血、痰培养明确病原体,根据药敏结果选择有效抗生素。对于应用带瓣管道且反复发热的患儿应至少 3 d 复查一次心脏超声排除感染性心内膜炎(ⅠC)。
6.4 消化道出血
消化道出血是比较少见但比较严重的并发症,多出现于术后数日,可能与应激性溃疡或手术损伤有关。出血量较大者,容易出现低血容量性休克。首选胃镜检查明确出血位置及原因,并止血。胃镜下止血困难者,行心血管造影检查,封堵出血的血管。紧急情况下使用三腔两囊管压迫止血(ⅠC)。
7 随访
术后应严密、长期随访,随访的项目包括患儿一般情况、血氧饱和度、肺动脉连接管道是否有狭窄及其瓣膜功能情况、固有肺动脉发育情况、未行单源化的侧枝变化情况、单源化侧枝血管及左右肺动脉开口是否有狭窄等。除了常规行心脏超声和心电图检查外,术后 1~6 个月行心导管检查。据文献报道每例患者行 1~6 次介入检查及治疗[36, 44-45](Ⅱa C)。
7.1 姑息手术患儿
评估肺动脉发育及侧枝血管变化情况,符合矫治手术适应证者制定下一步手术方案。没有达到矫治适应证者,进一步促进肺动脉发育。如果吻合口及左右肺动脉开口狭窄,积极行球囊扩张;中央分流管道狭窄的,尽快改行右室肺动脉连接术。
7.2 矫治手术患儿
肺动脉特别是左肺动脉开口狭窄是常见并发症,首选介入治疗(ⅠC)。对于长段狭窄,球囊扩张效果不良的可考虑手术矫治。对于保留室间隔或房间隔分流者,如明确为左向右分流者,心导管检查肺血管阻力低于 8 Wood·单位 ,可封堵残余室间隔缺损及房间隔缺损(Ⅱa C)。
7.3 术中应用人工血管患儿
术中应用人工血管患儿术后常规口服阿司匹林(3~5)mg/(kg·d),抗凝治疗半年(ⅠC)。
利益冲突:无。
主笔专家:陈欣欣(广州市妇女儿童医疗中心)、马力(广州市妇女儿童医疗中心)、邹明晖(广州市妇女儿童医疗中心)
审稿专家:邢泉生(青岛市妇女儿童医院)、李炘(苏州大学附属儿童医院)
临床问题提出专家及讨论专家:安琪(四川大学华西医院)、曹华(福建省妇幼保健院)、岑坚正(广东省人民医院)、陈寄梅(广东省人民医院)、陈良万(福建医科大学附属协和医院)、陈瑞(青岛市妇女儿童医院)、陈欣欣(广州市妇女儿童医疗中心)、崔虎军(广东省人民医院)、丁以群(深圳市儿童医院)、董念国(华中科技大学同济医学院附属协和医院)、赁可(四川大学华西医院)、杜心灵(华中科技大学同济医学院附属协和医院)、范太兵(华中阜外医院)、顾海涛(江苏省人民医院)、花中东(中国医学科学院阜外医院)、黄鹏(湖南省儿童医院)、贾兵(复旦大学附属儿科医院)、李建华(浙江大学医学院附属儿童医院)、李守军(中国医学科学院阜外医院)、李晓峰(首都医科大学附属北京儿童医院)、李炘(苏州大学附属儿童医院)、罗毅(首都儿科研究所附属儿童医院)、明腾(江西省儿童医院)、莫绪明(南京医科大学附属儿童医院)、彭帮田(华中阜外医院)、孙国成(空军军医大学西京医院)、王辉山(中国人民解放军北部战区总医院)、吴忠仕(中南大学湘雅二医院)、闫军(中国医学科学院阜外医院)、杨克明(中国医学科学院阜外医院)、杨一峰(中南大学湘雅二医院)、张本青(中国医学科学院阜外医院)、张海波(上海交通大学医学院附属上海儿童医学中心)、张浩(上海交通大学医学院附属上海儿童医学中心)、张辉(首都儿科研究所附属儿童医院)、张近宝(中国人民解放军西部战区总医院)、张泽伟(浙江大学医学院附属儿童医院)、郑景浩(上海交通大学医学院附属上海儿童医学中心)、祝忠群(上海交通大学医学院附属上海儿童医学中心)、周诚(华中科技大学同济医学院附属协和医院)
参考文献略。

