《柳叶刀》子刊:HER2胃癌/食管癌新进展
点击:186次时间:2020-06-22 14:57:02
最近几年的免疫治疗,在成果上似乎有点“青黄不接”,不复刚出道那几年接连不断的闪光和惊艳。在深水区的探索,有些时候的确需要时间,才能拿出漂亮的战果。还记得前两天,免疫治疗在肝癌的战场上传来捷报吗?这可是中国最多见的癌症之一。而最近,另外两种中国多发的癌症——胃癌和食管癌治疗上也传来了好消息。
一项由纪念斯隆-凯特琳癌症中心(MSKCC)开展的临床II期试验显示:PD-1抑制剂帕博利珠单抗+靶向HER2的曲妥珠单抗+化疗的联合治疗,有望用于HER2阳性晚期胃、胃食管连接部和食管鳞癌的一线治疗。
在这项试验中,联合治疗让患者的中位总生存期(OS)达到27.3个月,客观缓解率(ORR)高达91%,都超越了HER2胃癌和食管癌治疗此前的历史最佳数据[1]!相关数据发表在《柳叶刀·肿瘤学》上。
晚期胃癌生存期突破两年,以前真不敢想
(图片来源:Pixabay)
中国每年新发的胃癌和食管癌,占到了全球的一半以上,而这两种癌症到了晚期都是出了名的难治。靶向HER2的曲妥珠单抗,此前基本上是一线治疗中靶向药物的“独苗”,联合化疗应用取得了一定的效果[2]。
但同样是靶向HER2,对付胃癌和食管癌可比乳腺癌难多了。其他的小分子HER2靶向药,抗体偶联药物T-DM1,甚至是曲妥珠+帕妥珠的双靶+化疗方案,都逐个败下阵来,没能在曲妥珠单抗+化疗方案的基础上,更进一步提升疗效[3-4]。
而所向披靡的PD-1抑制剂,在胃癌上也遭遇了相似的困境,到现在使用仍然局限于三线治疗。所以PD-1抑制剂与曲妥珠单抗的联手,更像是一种困局之下的竭力尝试,能不能有增效机制和足够的抗肿瘤效果,都要看实战结果了。
本次由MSKCC开展的试验总共入组了37名患者,但在治疗方案上还有些细微的差别,其中有25名患者是先接受了一个周期的帕博利珠单抗+曲妥珠单抗诱导治疗,然后从第二个周期再加上化疗,而另外12名患者是直接加上了化疗。
试验的主要终点,设定为患者6个月时的疾病无进展生存率(6-month PFS)。研究团队认为只有这一指标达到70%,帕博利珠单抗+曲妥珠单抗+化疗的方案,才有后续III期试验探索的价值。次要终点则包括了OS、ORR、安全性数据等指标。
这项试验的初步结果,在2019年初的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上发布,87%的客观缓解率当时就让许多专家眼前一亮,毕竟曲妥珠单抗+化疗方案的客观缓解率,此前也不超过50%[5]。
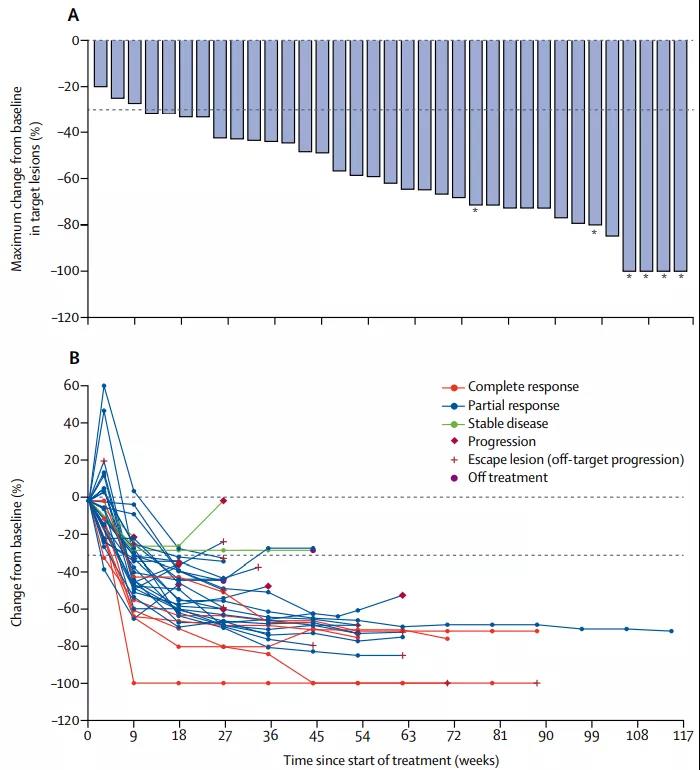
客观缓解率虽然不能预测全部患者的预后,但在免疫治疗时代也是非常有力的疗效指标
本次论文正式公布的PFS和OS数据,更可以说是大成功了:37名患者的6个月PFS率正好是70%,而13个月的中位PFS时间、27.3个月的中位OS,都比此前曲妥珠单抗+化疗方案的数据,提高了近70%!
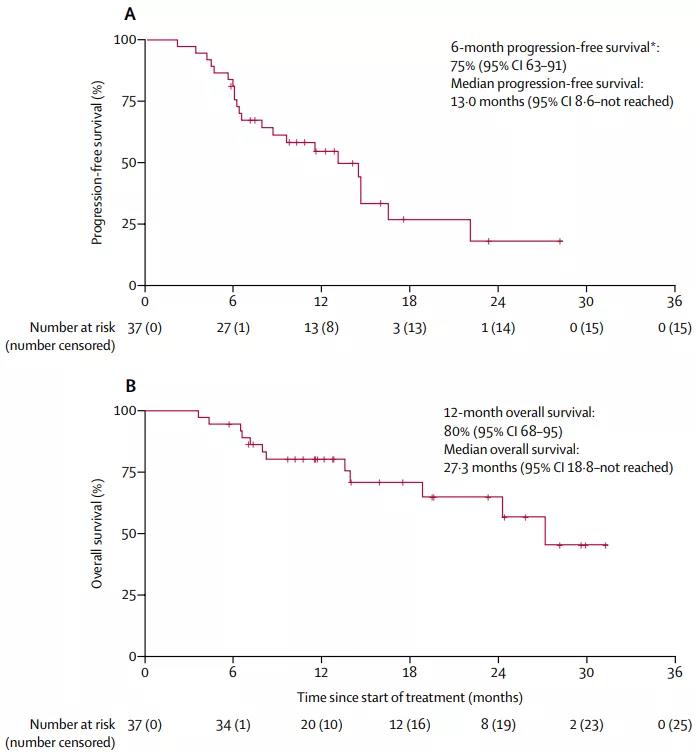
还是那句老话,一旦缓解就能长期获益
治疗的不良事件数据,整体上与曲妥珠单抗+化疗的试验差异不大,也就是说联合治疗安全性同样可控。此外分析也显示,患者是否先接受第一个周期的诱导治疗,与最终的疗效没有明显关联。
而患者的活检样本二代基因测序、免疫组化检查等结果显示,除了二代测序确认的HER2扩增之外,PD-L1表达水平、TP53等基因突变情况、肿瘤突变负荷(TMB)等指标,都没有体现预测疗效的价值。
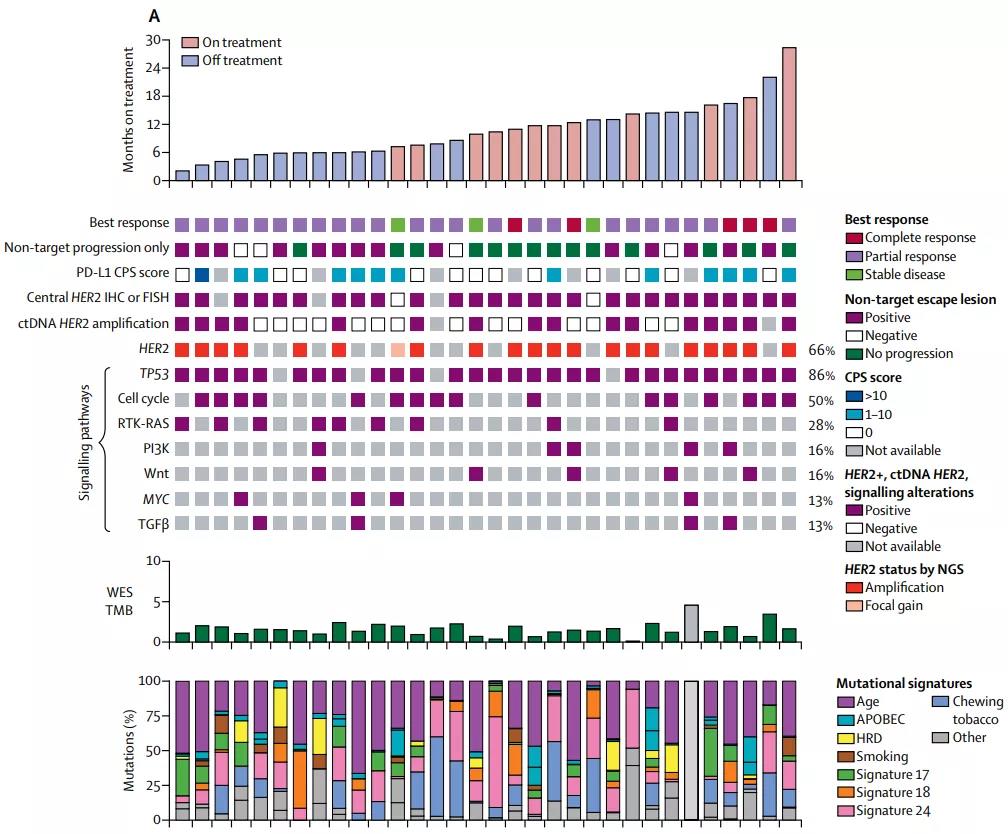
但HER2检测的可靠度比较重要,免疫组化的结果还需要测序来复核
不过本次试验入组的患者当中,并没有检出微卫星不稳定性高(MSI-H)和EB病毒阳性的患者。从理论上说,这两个指标可能提示患者新抗原更多,更适合免疫治疗,所以还是有望作为预测疗效的生化标记物。
至于联合治疗在本次试验中大获成功的原因,研究团队认为,可能与帕博利珠单抗增强曲妥珠单抗的主要杀伤机制——抗体依赖细胞介导的细胞毒性作用(ADCC)、曲妥珠单抗能上调癌细胞PD-L1表达水平等原因有关[6-7]。
具体是怎么一回事,就要等后续的基础科研和临床试验给出答案啦。基于这项II期试验的成功数据和方案,大规模的临床III期试验KEYNOTE-811也已启动,希望到时候也能传来振奋人心的好消息
参考资料:
1.Janjigian Y Y, Maron S B, Chatila W K, et al. First-line pembrolizumab and trastuzumab in HER2-positive oesophageal, gastric, or gastro-oesophageal junction cancer: an open-label, single-arm, phase 2 trial [J]. The Lancet Oncology, 2020.
2.Bang Y J, Van Cutsem E, Feyereislova A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. The Lancet, 2010, 376(9742): 687-697.
3.Tabernero J, Hoff P M, Shen L, et al. Pertuzumab plus trastuzumab and chemotherapy for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (JACOB): final analysis of a double-blind, randomised, placebo-controlled phase 3 study[J]. The Lancet Oncology, 2018, 19(10): 1372-1384.
4.Mitani S, Kawakami H. Emerging Targeted Therapies for HER2 Positive Gastric Cancer That Can Overcome Trastuzumab Resistance[J]. Cancers, 2020, 12(2): 400.
5.https://www.ascopost.com/issues/february-10-2019/first-line-trastuzumab-plus-pembrolizumab-shows-efficacy-in-patients-with-metastatic-esophagogastric-cancer/
6.Melero I, Berman D M, Aznar M A, et al. Evolving synergistic combinations of targeted immunotherapies to combat cancer[J]. Nature Reviews Cancer, 2015, 15(8): 457-472.
7.Savas P, Loi S. Investigating the positive relationship between tumor-infiltrating lymphocytes and trastuzumab therapy[J]. Immunotherapy, 2014, 6(7): 803-805.

